
分析 (1)根据化学反应方程式,将氢氧化钠的量代入计算来求收集到标准状况下的氢气;
(2)所以取200g溶质质量分数为0.265饱和食盐水进行电解,当NaCl反应了一半时,NaCl的质量=200g×0.265×0.5=26.5g,
先利用化学反应方程式,将计算生成氢氧化钠的质量,氢气和氯气的质量,注意总质量应为减去氢气和氯气的质量.
解答 解:1.电解池的阳极上是氯离子失电子产生氯气,阴极上是氢离子得电子生成氢气,电解氯化钠溶液的原理方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,产生0.2mol NaOH时,则生成0.1mol氢气,所以能收集到标准状况下的H22.24L;
故答案为:2.24;
2.电解氯化钠溶液的原理方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,
(1)所以取200g溶质质量分数为0.265饱和食盐水进行电解,当NaCl反应了一半时,NaCl的质量=200g×0.265×0.5=26.5g,
答:所得混合溶液中NaCl的质量为26.5g;
(2)消耗氯化钠为$\frac{200g×0.265×0.5}{58.5g/mol}$=0.453mol,所以生成氢氧化钠的质量为0.453mol×40g/mol=18.12g,放出氢气和氯气共0.453×0.5×71+0.453×0.5×2=16.534g,则NaOH的质量分数为$\frac{18.12g}{200g-16.534g}$=0.099,
答:所得溶液中NaOH的质量分数为0.099.
点评 本题考查学生电解氯化钠溶液的基本工作原理知识,注意知识的积累是解题的关键,题目难度中等,注意电解过程中反应产物判断和计算.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 蔬菜水果多属于碱性食物,对人体健康有益 | |
| B. | 棉花、合成橡胶都属于合成材料 | |
| C. | 蚕丝、羊毛完全燃烧只生成CO2和H2O | |
| D. | 苯、植物油均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(硝基苯) | B. | 乙醇(乙酸) | C. | 乙酸乙酯(乙酸) | D. | 乙酸(苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
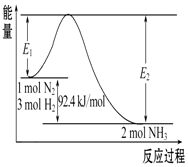 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
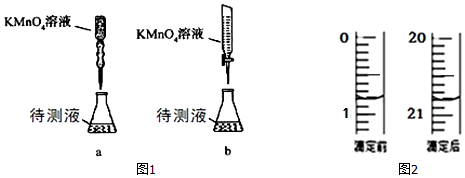
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
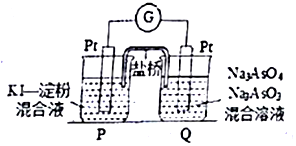 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com