
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答: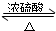 CH3CO18OC2H5+H2O,
CH3CO18OC2H5+H2O,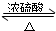 CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| a | b | c | d | |
| b | 无明显现象 | 有气体生成 | 有沉淀生成 | |
| c | 有气体生成 | 有气体生成 | 有沉淀生成 |
| A、H2SO4、Na2CO3、BaCl2、HCl |
| B、HCl、H2SO4、Na2CO3、BaCl2 |
| C、H2SO4、HCl、Na2CO3、BaCl2 |
| D、BaCl2、Na2CO3、HCl、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ组 | Ⅱ组 | Ⅲ组 | Ⅳ组 | ||
| 醇 | C2H5OH | C4H9OH | X | CH3CH(OH)CH(OH)CH3 | … |
| 酸 | HCOOH | CH3CH2COOH | H2CO3 | HOOC-COOH | … |
| A、C3H10O |
| B、C2H6O2 |
| C、C4H10O |
| D、C3H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2溶液、Ba(NO3)2溶液、NaCl溶液 |
| B、Na2CO3溶液、BaCl2溶液、MgCl2溶液 |
| C、Ba(NO3)2溶液、KCl溶液、MgCl2溶液 |
| D、Na2CO3溶液、K2CO3溶液、NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、Na2SO4 |
| C、HCl溶液 |
| D、AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com