
| A. | C2H6O | B. | C2H4O | C. | C2H6O2 | D. | CH4O |
分析 浓硫酸增重的为水的质量,碱石灰增重的为二氧化碳的质量,根据n=$\frac{m}{M}$计算出二氧化碳和水的物质的量,根据质量守恒判断含有氧元素的质量,再根据n=$\frac{m}{M}$计算出9.2g该有机物中含有氧原子的物质的量,最后计算出该有机物的最简式,根据最简式对各选项进行判断.
解答 解:将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重10.8g为水的质量,碱石灰增重17.6g为二氧化碳的质量,
生成水的物质的量为:$\frac{10.8g}{18g/mol}$=0.6mol,9.2g该有机物分子中含有H原子的物质的量为:0.6mol×2=1.2mol,
生成二氧化碳的物质的量为:$\frac{17.6g}{44g/mol}$=0.4mol,9.2g该有机物分子中含有C子的物质的量为0.4mol,
9.2g该有机物分子中含有氧原子的物质的量为:$\frac{9.2g-12g/mol×0.4mol-1g/mol×1.2mol}{16g/mol}$=0.2mol,
该有机物分子中含有C、H、O原子的物质的量之比为:0.4mol:1.2mol:0.2mol=2:6:1,
该有机物的最简式为C2H6O,由于H原子已经饱和,该有机物分子式为C2H6O,
故选A.
点评 本题考查了有机物分子式确定的计算,题目难度中等,注意掌握质量守恒定律、最简式法在确定有机物分子式中的应用方法,试题侧重考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
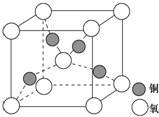 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量前先调节托盘天平的零点 | |
| B. | 称量时左盘放被称量物,右盘放砝码 | |
| C. | 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| D. | 用托盘天平可以准确称量至0.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,请回答下列问题:
,请回答下列问题: .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 向0.1mol•L-1CH3COONa溶液加入少量水,溶液中$\frac{c(CHCO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(C{l}^{-})}$>1 | |
| D. | 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中$\frac{c(Cl-)}{c(B{r}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的原电池装置,X、Y为两电极,电解质溶液为硫酸铜,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为硫酸铜,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| B. | 外电路的电流方向为:X→外电路→Y | |
| C. | 若两电极都是金属,则它们的活动性为X<Y | |
| D. | 若两电极分别为Zn和石墨棒,则Y极质量增重 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无水乙醇与足量金属钠反应生成5.6LH2(标况),则该乙醇分子中共价键总数为4NA | |
| B. | 标况下,22.4L甲烷与22.4L氯气在光照下充分反应,生成的CH3Cl分子数一定为NA | |
| C. | 在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后得到NH3分子数为NA | |
| D. | 常温常压,56g铁片投入足量浓硫酸中生成SO2分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
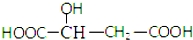 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| C. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| D. | 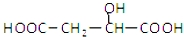 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com