

| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
分析 实验室以含有Ca2+、Mg2+、Cl-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,应将混合物中的Mg2+、SO42-、Br-等离子除去,根据流程可以看出分别加入氯气将溶液中的Br-氧化溴单质,加入氯化钡除去SO42-,用CaO调节溶液Y的pH,可以除去Mg2+.
(1)单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗;
(2)分析表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;除杂时不能引入新的杂质;
(3)CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必需插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来;
(4)工业上电解熔融MgCl2得Mg和氯气;
(5)A.用肥皂水检验软、硬水,泡沫多的为软水,泡沫少的为硬水;
B.食醋能与氧化铁反应;
C.小苏打片能与胃酸反应并且碱性很弱;
D.生石灰与水反应;
E.乙烯具有催熟作用;
F.福尔马林有毒;
解答 解:(1)氯气具有强氧化性,通入氯气后可以将溶液中的Br-氧化溴单质,因为单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗.由流程图可知单质溴在下层,因此该有机溶剂的密度要比水的大且不溶于水,所以该试剂是CCl4,故答案为:CCl4;分液漏斗;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;由表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,
故答案为:除去溶液中的SO42-;11.0≤pH<12.2;盐酸;
(3)实验室制取CO2的特点是固体和液体反应且不需要加热,由于盐酸易挥发,因此在收集之前需要出去挥发出HCl气体,因为CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必须插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来,因此选项b、d正确,故答案为:bd;
(4)工业上电解熔融MgCl2得Mg和氯气,化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(5)A、用肥皂水检验软、硬水,泡沫多的为软水,泡沫少的为硬水,不是用活性炭,故A错误;
B、食醋能与氧化铁反应,所以用食醋除铁锈,故B正确;
C、小苏打片能与胃酸反应并且碱性很弱,所以用小苏打片治疗胃酸过多,故C正确;
D、生石灰与水反应,所以用生石灰作食品干燥剂,故D正确;
E、乙烯具有催熟作用,则乙烯可以作水果的催熟剂,故E正确;
F、福尔马林有毒,不能作为食品保鲜剂,故F错误;
故选:AF.
点评 本题主要考查常见的基本实验操作、仪器的使用和实验方案设计,综合性强,难度大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | K越大,反应达到平衡时所用的时间越短 | |
| B. | K越小,达到平衡时,反应物的 转化率越大 | |
| C. | K随反应物浓度改变而改变 | |
| D. | K越大,达到平衡时,反应进行的程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
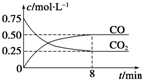 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com