
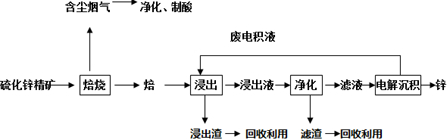
分析 (1)焙烧中硫化锌与氧气在高温下反应生成氧化锌和二氧化硫;
(2)①ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
②锌的活泼性强于铁,能够与二价铁离子反应生成铁;
③依据题意“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,可知反应物中含有H+和O2,可以获得非金属单质S;
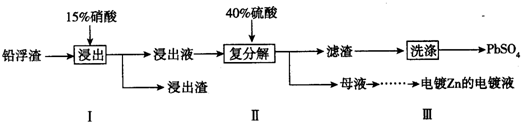
(3)①根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,据此写出方程式;
②铅浮渣中含银,银也和硝酸反应;硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4;
③Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,过滤得滤液含硝酸;铁棒上镀锌,镀层金属作阳极,锌作阳极;
(4)正极得电子发生还原反应,根据总反应书写电极方程式.
解答 解:(1)由题中信息可知,闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,反应的化学方程式为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;
故答案为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;
(2)①ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
故答案为:浸出;
②该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,离子方程式:Zn+Fe2+=Zn2++Fe;
故答案为:置换出Fe等,以达到净化的目的;
③“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,写出化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O,
故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(3)①根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,故反应方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
故答案为:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
②若硝酸过量,则过量的硝酸会和银反应生成硝酸银,产品中会有杂质,所以步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液;硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,
故答案为:防止Ag被溶解进入溶液(或使Ag留在浸出渣中);除去附着在硫酸铅表面的微溶物硫酸钙;
③Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,所以母液可循环利用于步骤I,其溶质主要是HNO3,铁棒上镀锌,镀层金属作阳极,锌作阳极,
故答案为:HNO3;Zn或锌;
(4)正极得电子发生还原反应,电极方程式为:Ag2O+H2O+2e-═2Ag+2OH-,
故答案为:Ag2O+H2O+2e-═2Ag+2OH-.
点评 本题为工艺流程题,为高考常见题型,侧重学生的分析、实验能力的考查,通过锌的炼制、金属的冶炼原理、电解原理及其应用,考查了化学方程式、离子方程式的书写及计算,物质分离提纯的方法,明确工艺流程及各种物质的性质是解题关键,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
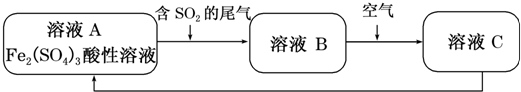
| A. | 向C溶液中滴加KSCN溶液,溶液变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水应密闭保存,放置于低温处 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
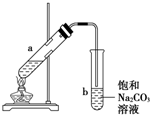
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 长玻璃导管只有导气的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
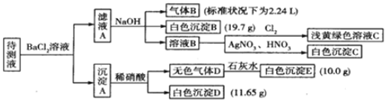
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若D与盐酸反应,可生成A和B,则X一定是H2O | |
| B. | 若D为NaCl,且A可与C反应生成B,则E 可能是CO2 | |
| C. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com