
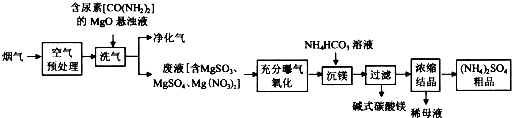
分析 根据题中工业流程可知,烟气中主要污染物为SO2、NO、NO2,在空气中预处理时,主要将NO氧化成NO2,再用含尿素的氧化镁悬浊液还原生成氮气和二氧化碳,同时溶液中有硫酸镁、亚硫酸镁、硝酸镁等物质生成,在充分曝气氧化中,亚硫酸镁被氧化成硫酸镁,再加入碳酸氢铵溶液生成碱式碳酸镁沉淀,过滤后将滤液浓缩结晶可得硫酸铵晶体,据此答题;
解答 解:根据题中工业流程可知,烟气中主要污染物为SO2、NO、NO2,在空气中预处理时,主要将NO氧化成NO2,再用含尿素的氧化镁悬浊液还原生成氮气和二氧化碳,同时溶液中有硫酸镁、亚硫酸镁、硝酸镁等物质生成,在充分曝气氧化中,亚硫酸镁被氧化成硫酸镁,再加入碳酸氢铵溶液生成碱式碳酸镁沉淀,过滤后将滤液浓缩结晶可得硫酸铵晶体,
(1)在空气中预处理时,主要将NO氧化成NO2,发生主要反应的化学方程式为2NO+O2=2NO2,
故答案为:2NO+O2=2NO2;
(2)根据上面的分析可知,洗气过程中,生成两种无污染的气体是CO2、N2,
故答案为:CO2、N2;
(3)在充分曝气氧化中,亚硫酸镁被氧化成硫酸镁,反应的化学方程式为2MgSO3+O2=2MgSO4,
故答案为:2MgSO3+O2=2MgSO4;
(4)镁离子和碳酸氢根离子发生双水解,生成碱式碳酸镁,根据电荷守恒和元素守恒可知其离子反应方程式为2Mg2++4HCO3-=MgCO3?Mg(OH)2↓+3CO2↑+H2O,
故答案为:2、4HCO3-、3、1;
(5)根据氮元素守恒可知,)(NH4)2SO4粗品中含有的主要杂质为硝酸铵,
故答案为:硝酸铵;
(6)碱式碳酸镁经过加热生成氧化镁和二氧化碳及水,氧化镁可循环利用,反应的方程式为MgCO3•Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+CO2↑+H2O,
故答案为:MgCO3•Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+CO2↑+H2O.
点评 本题以流程形式考查脱硫脱硝及产物回收的工艺流程等,难度中等,涉及反应方程式的书写、离子方程式的配平等,理解工艺流程是解题关键,是对知识迁移的综合运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)>c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化得到汽油 | |
| C. | 石油的裂解是化学变化,石油的分馏是物理变化 | |
| D. | 石油裂解气的主要成分是各种烯烃,并不含有烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO=═2Fe+3CO2△H=-28.5 kJ•mol-1 | |
| B. | Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-28.5 kJ | |
| C. | Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=+28.5 kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com