
分析 5min末已生成0.2molW,v(W)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02mol/(L•min),以Z浓度变化来表示的反应平均速率为0.02mol/(L•min),由速率之比等于化学计量数之比可知n=2,则
3X(气)+Y(气)═2Z(气)+2W(气)
开始 0.6 0.4 0 0
转化 0.3 0.1 0.2 0.2
平衡 0.3 0.3 0.2 0.2
结合转化率=$\frac{转化的量}{开始的量}$×100%、v=$\frac{△c}{△t}$、c=$\frac{n}{V}$、物质的量比等于压强比计算.
解答 解:5min末已生成0.2molW,v(W)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02mol/(L•min),以Z浓度变化来表示的反应平均速率为0.02mol/(L•min),由速率之比等于化学计量数之比可知n=2,则
3X(气)+Y(气)═2Z(气)+2W(气)
开始 0.6 0.4 0 0
转化 0.3 0.1 0.2 0.2
5min 0.3 0.3 0.2 0.2
(1)由上述分析可知,n=2,答:n值为2;
(2)前5min以X浓度变化来表示的反应平均速率为$\frac{\frac{0.3mol}{2L}}{5min}$=0.03mol/(L•min),答:前5min内用X表示的反应速率为0.03mol/(L•min);
(3)平衡时Y的物质的量浓度为$\frac{0.3mol}{2L}$=0.15mol/L,答:平衡时Y的物质的量浓度为0.15mol/L;
(4)平衡时容器内的压强与初始时压强的比值为$\frac{0.3mol+0.3mol+0.2mol+0.2mol}{0.4mol+0.6mol}$=1:1,答:平衡时容器内的压强与初始时压强的比值为1:1.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率等为解答的关键,侧重分析与计算能力的考查,注意物质的量比与压强比的关系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( ) | A. | ①②③ | B. | ①③ | C. | ①② | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
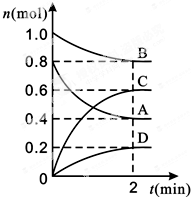 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
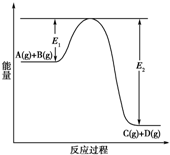 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com