
下列装置用于实验室中制取干燥氨气的实验,能达到实验目的的是( )
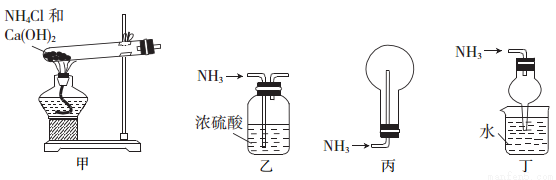
A.用装置甲制备氨气 B.用装置乙除去氨气中少量水
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届安徽省淮北市濉溪县高三上学期9月月考化学试卷(解析版) 题型:填空题
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
⑴ 从物质的分类角度看,不恰当的一种物质是 (填名称);
⑵ “三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式 , ;
⑶ “三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是______(填字母序号);
A.Ag B.Cu C.Al D.Fe
⑷ 烧碱、纯碱均可吸收CO2,当含0.1mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
① ;②Na2CO3;③ ;④NaHCO3。
将得到的固体重新溶解于水,向溶液中加入过量的稀盐酸,再将溶液蒸干,得到固体的质量是______g。
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三上第二次检测化学试卷(解析版) 题型:实验题
已知亚硫酸为二元中强酸,不稳定,易被氧化。请回答下列问题:
(1)下列有关亚硫酸的性质的判断正确的是______(填标号)。
a.具有酸性 b.具有氧化性 c.具有还原性 d.有刺激性气味
(2)亚硫酸在水中电离的方程式为______________________。
(3)将亚硫酸钠(Na2SO3)溶液滴人到几种不同溶液中的现象如下表所示:
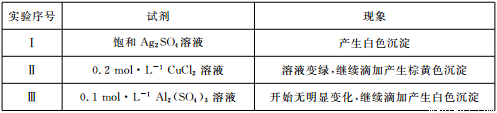
①经检验,实验I中的白色沉淀是Ag2SO3。用离子方程式解释:__________________。
②经检验,实验Ⅱ中的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。推测反应后的溶液中一定含有溶质电离出的阴离子是______________,请选用合适的试剂分别验证这些离子:________________。
③已知:Al2(SO3)3在水溶液中不存在。经检验,实验Ⅲ中的白色沉淀中无SO2,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。推测沉淀中含有的阴离子为_______。
查看答案和解析>>
科目:高中化学 来源:2017届河南省灵宝市高三上学期9月月考化学试卷(解析版) 题型:实验题
(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
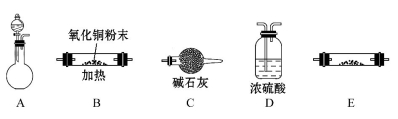
①各仪器的连接顺序为________________,装置C的作用是_________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、锌粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
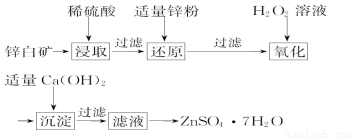
①为了提高酸浸效率,可以采取的措施有_____________、 (写出两条即可)。
②氧化过程中H2O2发生反应的离子方程式为___________________________。
③由滤液得到ZnSO4·7H2O的操作依次为__________、___________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2017届河南省灵宝市高三上学期9月月考化学试卷(解析版) 题型:选择题
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
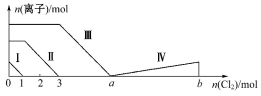
A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2)∶n(FeBr2)=3∶1
C.根据图象无法计算a的值
D.线段Ⅳ表示IO3-的变化情况
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:填空题
呼吸面具中Na2O2可吸收CO2放出O2,反应方程式为2Na2O2+2CO2 2Na2CO3+O2。若用超氧化钾(KO2)代替 Na2O2也可起到同样的作用。
2Na2CO3+O2。若用超氧化钾(KO2)代替 Na2O2也可起到同样的作用。
(1)写出KO2与CO2的反应方程式:______________。
(2)1 kg Na2O2和1 kg KO2分别和CO2反应,生成的O2体积比(同温同压下)为____________。
(3)等物质的量的CO2分别与足量Na2O2、KO2反应生成的O2体积比(同温同压下)为____________。
(4)你认为选用哪种物质作补氧剂更为合适?理由是什么?_______________________
查看答案和解析>>
科目:高中化学 来源:2017届广东省等四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量热量 |
B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
C | 过氧化钠用于呼吸面具中作为氧气的来源 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
D | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | 高锰酸钾能氧化水果释放的催熟剂乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com