
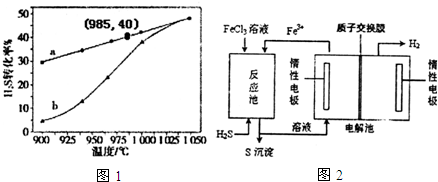
分析 (1)利用盖斯定律,将①×2+②×2+③可得反应2H2S(g)+4CH3OH(l)+O2(g)=2(CH3)2SO(l)+2H2O(g);根据题中的三个反应可知,二氧化氮氧化(CH3)2S,得到一氧化氮,一氧化氮又被氧化成二氧化氮,据此判断;
(2)根据题意,H2S起始浓度为5mol•L-1,985℃时H2S的转化率为40%,利用三段式可计算出平衡时各物质的浓度,进而确定平衡常数;根据温度对速率的影响分析;当反应处于平衡状态时v正=v逆,结合平衡常数进行计算;
(3)根据装置图可知,①反应池中用铁离子将硫化氢氧化成硫,铁离子被还原成亚铁离子;
②反应后的溶液为氯化亚铁溶液,电解氯化亚铁时,阳极上亚铁离子被氧化成铁郭,阴极上水中的氢离子被还原成氢气,据此书写电解方程式;
(4)根据c(Cu2+)/c(Zn2+)=$\frac{c(C{u}^{2+})c(S{\;}^{2-})}{c(Z{n}^{2+})c({S}^{2-})}$=$\frac{Ksp(CuS)}{Ksp(ZnS)}$计算;
解答 解:(1)利用盖斯定律,将①×2+②×2+③可得反应2H2S(g)+4CH3OH(l)+O2(g)=2(CH3)2SO(l)+2H2O(g),所以生成l mol二甲基亚砜的△H=△H1+△H2+$\frac{1}{2}$△H3,根据题中的三个反应可知,二氧化氮氧化(CH3)2S,得到一氧化氮,一氧化氮又被氧化成二氧化氮,所以循环的物质是NO2,
故答案为:△H1+△H2+$\frac{1}{2}$△H3;NO2;
(2)H2S起始浓度为5mol•L-1,985℃时H2S的转化率为40%,则
2H2S(g)?2H2(g)+S2(g),
开始(mol•L-1) 5 0 0
转化(mol•L-1) 0.4×5 2 1
平衡(mol•L-1) 3 2 1
K=$\frac{1×{2}^{2}}{{3}^{2}}$=0.44;随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
当反应处于平衡状态时v正=v逆,根据v正=k正x2(H2S),v逆=k逆x2(H2)x(S2),可得k正x2(H2S)=k逆x2(H2)x(S2),所以k正=k•k逆,k逆=$\frac{k{\;}_{正}}{k}$,
故答案为:0.44;温度升高,反应速率加快,达到平衡所需时间缩短;$\frac{k{\;}_{正}}{k}$;
(3)根据装置图可知,①反应池中用铁离子将硫化氢氧化成硫,铁离子被还原成亚铁离子,反应的离子方程式为H2S+2Fe3+=2Fe2++S↓+2H+,
故答案为:H2S+2Fe3+=2Fe2++S↓+2H+;
②反应后的溶液为氯化亚铁溶液,电解氯化亚铁时,阳极上亚铁离子被氧化成铁郭,阴极上水中的氢离子被还原成氢气,所以电解的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑,
故答案为:2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑;
(4)根据题意,c(Cu2+)/c(Zn2+)=$\frac{c(C{u}^{2+})c(S{\;}^{2-})}{c(Z{n}^{2+})c({S}^{2-})}$=$\frac{Ksp(CuS)}{Ksp(ZnS)}$=$\frac{1.3×10{\;}^{-36}}{2.0×10{\;}^{-22}}$=6.5×10-15,
故答案为:6.5×10-15.
点评 本题主要考查了盖斯定律的应用、平衡状态的判断、沉淀溶解的平衡计算以及电化学知识,难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
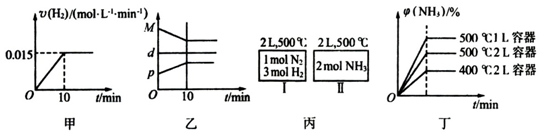
| A. | 若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 | |
| B. | 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 | |
| C. | 如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ | |
| D. | 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||
| B. | H2(g)+Br2(g)═2HBr(g)△H=-72kJ•mol-1其它相关数据如下表:
| |||||||||
| C. | 在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则热化学方程式为Fe(s)+S(s)═FeS(s);△H=-95.6 kJ•mol-1 | |||||||||
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为-241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 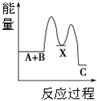 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 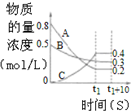 图表示反应的化学方程式为3A+B═2C | |
| C. | 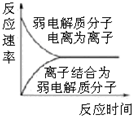 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 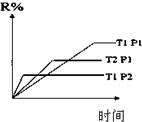 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com