
分析 (1)A.因Ni是固体,改变用量对反应物的转化率无影响;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变;
C.根据外界条件和该反应本身的特点进行分析;
D.根据不同物质的速率关系判断可逆反应时,应当一正一逆,速率之比等于系数比;
(2)分析目标反应和已知反应,运用盖斯定律即可求得目标反应的△H;
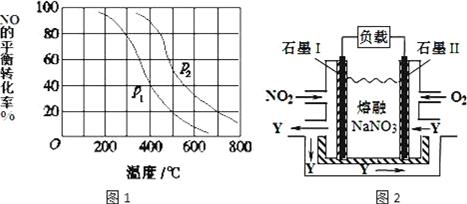
(3)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大;
②700℃时,在压强为P2时,由图象知NO平衡转化率为20%,则反应消耗NO2mol,氧气为1mol,生成二氧化氮为2mol,根据平衡时浓度的幂次方之积之比计算K;
(4)据题意,根据通入气体判断两极,电极反应式和电池反应式,根据电池总反应4NO2+O2=2N2O5,求出消耗O2的量.
解答 解:(1)A.Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,故A错误;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,故B错误;
C.因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,故C正确;
D.速率关系未说明正、逆,不能判断是否已达平衡;因该反应气体质量增加而容积不变,所以混合气体密度是一个变量,当不变时说明反应达平衡,故D错误;
故答案为:C;
(2)根据已知:①CO (g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-Q1 kJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1
则运用盖斯定律,SO2(g)+2CO(g)═S(s)+2CO2(g)可由①×2-②得到,则△H=-(2Q1-Q2)kJ•mol-1,故答案为:-(2Q1-Q2)kJ•mol-1;
(3)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1,故答案为:p2>p1;
②700℃时,在压强为P2时,由图象知NO平衡转化率为20%,则反应消耗NO2mol,氧气为1mol,生成二氧化氮为2mol,平衡时NO为8mol,氧气为9mol,生成二氧化氮为2mol,则K=$\frac{2{\;}^{2}}{8{\;}^{2}×9}$=$\frac{1}{144}$;
故答案为:$\frac{1}{144}$;
(4)据题意,通O2一极为正极,电极反应式为O2+2N2O5+4e-=4NO3-;通NO2一极为负极,电极反应为:NO2+NO3--e-=N2O5,根据电池总反应4NO2+O2=2N2O5,收集到20molN2O5需消耗O2为10mol,标准状况下体积为224L.
故答案为:O2+2N2O5+4e-=4NO3-;224.
点评 本题以碳和氮的化合物为载体考查化学平衡、热化学方程式及电化学的相关知识,综合性较强.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 (改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
(改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- | |
| C. | 加入金属铝产生H2的溶液中:Na+、K+、SO42-、Cl- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
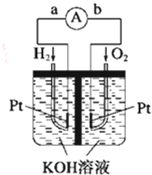 燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
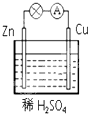 在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.
在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、Al3+、K+ | B. | Na+、ClO3-、ClO-、ClO4- | ||
| C. | K+、Cr2O72-、I-、Na+ | D. | Na+、SO32-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 上述各物质中能发生水解反应的有A、B、D、G | |
| B. | 根据图示可推知D为苯酚 | |
| C. | A的结构中含有碳碳双键 | |
| D. | G的同分异构体中属于酯且能发生银镜反应的只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com