
见解析
(1)Fe3+和I-在溶液中将发生氧化还原反应:2Fe3++2I-(或3I-)=2Fe2++I2(或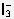 )。反应中Fe3+被还原为Fe2+,I-被氧化为I2(或
)。反应中Fe3+被还原为Fe2+,I-被氧化为I2(或 )而使溶液呈棕褐色。
)而使溶液呈棕褐色。
(2)当向(1)的溶液中加入F-时,Fe3+将首先和F-发生配合反应生成FeF2+或更复杂的配合离子而使溶液中的Fe3+浓度降低,(1)中的反应无法进行。
(3)因F-和 Fe3+(残余)配合,使反应2Fe3++2I-(或3I-) 2Fe2++I2(或
2Fe2++I2(或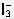 )向左移动,随着I2浓度的降低,棕色溶液颜色逐渐变浅甚至变为无色。
)向左移动,随着I2浓度的降低,棕色溶液颜色逐渐变浅甚至变为无色。
(4)因F-和H+结合生成HF,使F-的浓度降低,一定程度上不利于Fe3+和F-的配合。因此,有少量Fe3+将与I-发生反应,即生成I2而使溶液呈现黄棕色。


科目:高中化学 来源:2013-2014学年甘肃省高三下学期第一次诊断考试理综化学试卷(解析版) 题型:填空题
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
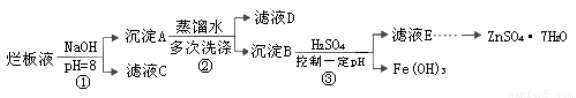
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是??????? 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式???????????????????????????????????????????????? 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有????????????? (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是??????? (填选项)。
A.Ksp[Zn(OH)2]??? B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3]??? C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是:?????????????????? 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH= a kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH= a kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH= b kJ?mol-1
H+(aq)+OH-(aq) ;ΔH= b kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式:???????????????????????????? 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K=????????????????? 。(用含KSP、KW的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省五校协作体高三上学期期中考试化学试卷(解析版) 题型:填空题
Ⅰ.(4分)实验室有一瓶澄清的溶液,实验人员确定其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-,取该溶液进行下列实验:
①取pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
⑥向②的水层中加入HNO3酸化的AgNO3溶液有白色沉淀。
根据上述实验事实确定,请你判断该溶液中
(1)肯定存在的离子是 ;
(2)不能确定是否存在的离子是 。
Ⅱ. (6分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+ 4KI+ 4HNO3→Se+2I2+ 4KNO3+2H2O ②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省绵阳市高三”二诊“模拟测试(一)化学试卷 (解析版) 题型:填空题
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
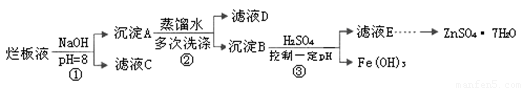
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq)
; ΔH= a kJ•mol-1
Fe3+(aq)+3OH-(aq)
; ΔH= a kJ•mol-1
②H2O(l)
 H+(aq)+OH-(aq) ;ΔH= b
kJ•mol-1
H+(aq)+OH-(aq) ;ΔH= b
kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。每生成1molNO转移电子的物质的量为 mol。
(2)实验室中可用已知浓度的酸性高锰酸钾溶液滴定含Fe2+的溶液,从而测定Fe2+的浓度,离子反应方程式如下,请在空格内填上缺少的反应物,并配平:
Fe2+ + MnO4- + — Fe3+ + Mn2+ + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com