
【题目】已知草酸为二元弱酸:
H2C2O4![]() HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4-![]() C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
【答案】C
【解析】
试题分析:A、pH=1.2溶液中,电荷守恒:c(K+)+c(H+)=c(OH-)+c(HC2O4-),从图分析c(HC2O4-)=c(H2C2O4),所以有c(K+)+c(H+)=c(OH-)+c(H2C2O4),正确,不选A;B、根据电离平衡常数分析,K1=c(H+)c(HC2O4-)/c(H2C2O4)=10-1.2,K2=c(H+)c(C2O42-)/c(HC2O4-)=10-4.2,K1/K2=c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=10-1.2/10-4.2=1000,所以不选B;C、在pH=4.2时,c(C2O42-)=c(HC2O4-),溶液显酸性,说明草酸氢根的电离大于水解,所以当加入的草酸氢钾和草酸钾等物质的量加入时,电离大于水解后,二者的浓度不再相等,所以不可能配成pH=4.2的溶液,选C;D、从pH=1.2变到pH=4.2,溶液的酸性减弱,对水的电离抑制作用减弱,所以水的电离程度一直增大,不选D。


科目:高中化学 来源: 题型:
【题目】氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。工业上用粗氧化铜(含Fe2O3、FeO、Cu2O以及少量不溶性杂质)为原料制取氯化铜晶体 (CuCl2·2H2O)的为生产流程如下:

己知:Cu2O在酸性环境中可以生成Cu2+和Cu 回答下列问题:
(1)己知“浸渣”中不含铜单质,写出Cu2O在“盐酸浸出”中发生反应的化学方程式:___________________________________________
(2)“盐酸浸出”中,铜的浸出率与浸出时间的关系如下图所示。由图可得出如下变化规律:

①____________________________
②______________________________。
(3)“净化除杂”需先加入C1O2,其作用是(用离子方程式表示)______________。
然后再调节溶液的pH约为4,可选用的试剂是(填选项字母)______________。
A. CuSO4 B.CuO C.Cu2(OH)2CO3 D.NH3·H2O
(4)“操作I”包含多步实验基本操作,依次是__________、洗涤和风干等。工业上常采用无水乙醇代替水进行洗涤的主要原因是______________。
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,称取ag晶体,加入足量10%的氢氧化钠溶液,过滤、洗涤后,用酒精灯加热至质量不再减轻为止,冷却、称量所得固体质量为bg。计算得x= ______________。(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:
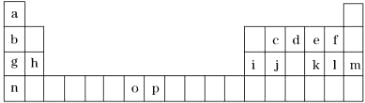
(1)元素o为25号元素,请写出其基态原子的电子排布式______.
(2)d与a反应的产物的分子中,中心原子的杂化形式为______.
(3)d、e、f三种元素的电负性大小顺序为(用元素符号表示)_________________.
(4)o、p两元素的部分电离能数据列于下表:

比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2一氯丙烷制取少量1,2一丙二醇时,需要经过下列哪几步反应
A、消去→加成→水解 B、加成→消去→取代
C、消去→加成→消去 D、取代→消去→加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有6种物质:①甲烷 ②苯 ③聚乙烯 ④乙烯 ⑤丙烯 ⑥己烷,既能使酸性高锰酸钾溶液褪色又能与溴水发生加成反应使之褪色的是( )
A. ③④⑤B. ④⑤C. ④⑤⑥D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1mol·L-1AlCl3溶液中,含Al3+数目小于NA
B. 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA
C. 25℃,1LpH=1的稀硫酸中含有的H+数为0.2NA
D. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COOˉ数目为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com