
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ��������:
�ٸ�������̼��ԭ���������Ƶôֹ�
�ڴֹ������HCl���巴Ӧ�Ƶ�SiHCl3: Si+3HC1![]() SiHCl3+H2
SiHCl3+H2
��SiHCl3�����H2��1000��1100�淴Ӧ�Ƶô��衣��֪SiHCl3����H2Oǿ�ҷ�Ӧ���ڿ���������ȼ��
��ش���������:
(1)������ȡ�ֹ�Ļ�ѧ����ʽ:_____________________��
(2)�ֹ���HCl ��Ӧ��ȫ�������õ���SiHCl3 (�е�33.0��) �к�������SiCl4(�е�57.6��)��HCl(�е�-84.7��)���ᴿSiHCl3���õķ���Ϊ______________��
(3)��SiHCl3�����H2��Ӧ�Ʊ������װ������(��Դ���г�װ����ȥ)��
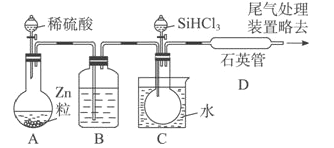
��װ��B�е��Լ���Ũ���ᡣװ��C �е���ƿ��Ҫ���ȣ���Ŀ����____________��
��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ____________��
��Ϊ������Ʒ�����Ƿ��������ʣ���������ϡ�����ܽ⣬ȡ�ϲ���Һ�����ټ�����Լ�(��д��ĸ����)��____________��
a.��ˮ b.��ˮ c.NaOH��Һ d.KSCN ��Һ e.Na2SO3
���𰸡� SiO2+2C![]() Si+2CO�� �������� ʹ������ƿ�е�SiHCl3���� SiHCl3+H2
Si+2CO�� �������� ʹ������ƿ�е�SiHCl3���� SiHCl3+H2![]() Si+3HCl b��d
Si+3HCl b��d
��������������������⿼��ֹ���Ʊ����ᴿ��Fe2+�ļ��飬��ѧ����ʽ����д��
��1����������̼��ԭSiO2����Si��CO����Ӧ�Ļ�ѧ����ʽΪ2C+SiO2![]() Si+2CO����
Si+2CO����
��2������SiHCl3����������SiCl4��HCl�ķе����ϴ���е㲻ͬ��Һ̬������÷������������ᴿSiHCl3���õķ���Ϊ����������
��3��װ��A��Zn��ϡ���ᷴӦ��ȡH2����Ӧ�Ļ�ѧ����ʽΪZn+H2SO4=ZnSO4+H2����
��װ��A���Ƶõ�H2�л���H2O��g����SiHCl3����ˮǿ�ҷ�Ӧ��װ��B��Ũ����������Ǹ���H2����������SiHCl3�����H2��1000~1100�淴Ӧ�Ƶô��裬SiHCl3�ķе�Ϊ33.0�棬װ��C�е���ƿ��Ҫ���ȵ�Ŀ����ʹ������ƿ�е�SiHCl3������
��װ��D��SiHCl3�����H2��Ӧ����Si��HCl����Ӧ�Ļ�ѧ����ʽΪSiHCl3+H2![]() Si+3HCl��
Si+3HCl��
����Ʒ�����������������ʣ�������ϡ�����ܽ���Fe��ϡ���ᷴӦ����FeCl2��H2��ֻҪ�����ϲ���Һ���Ƿ�Fe2+�����жϲ�Ʒ���Ƿ�������������Fe2+ѡ����ˮ��KSCN��Һ��ʵ�鷽��������������ϡ�����ܽ⣬ȡ�ϲ���Һ����KSCN��Һ���ټ�����ˮ������Һ��죬˵�������к�����������ط�ӦΪFe+2H+=Fe2++H2����Cl2+2Fe2+=2Fe3++2Cl-��Fe3++3SCN-=Fe��SCN��3����ѡb��d��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ��ǣ� �� 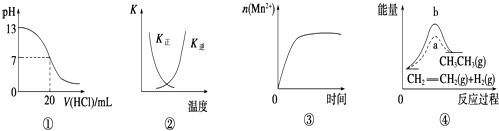
A.ͼ�ٱ�ʾ25��ʱ����0.1 mol/L����ζ�20 mL 0.1 mol/L NaOH��Һ����Һ��pH�����������ı仯
B.ͼ�������߱�ʾ��Ӧ2SO2��g��+O2��g��2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C.ͼ�۱�ʾ10 mL 0.01 mol/L KMnO4������Һ�������0.1 mol/L H2C2O4��Һ���ʱ��n��Mn2+����ʱ��ı仯
D.ͼ����a��b���߷ֱ��ʾ��Ӧ��CH2�TCH2��g��+H2��g����CH3CH3��g����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е��������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ������ȷ���ǣ�![]() �ľ���ֵ����ȷ��
�ľ���ֵ����ȷ��
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) ��H=�C1367.0 kJ/mol��ȼ���ȣ�
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) ��H= +57.3kJ/mol���к��ȣ�
C. S(s)+O2(g)=SO2(g) ��H=�C269.8kJ/mol ����Ӧ�ȣ�
D. 2NO2=O2+2NO ��H= +116.2kJ/mol ����Ӧ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Al��C12��Al2O3��HCl(aq)��Al(OH)3��NaOH(aq)�������ʣ�����֮������ͼ��ʾת����ϵ��ͼ��ÿ�������˵�����֮�䶼���Է�����Ӧ�������ƶϲ��������ǣ� ��
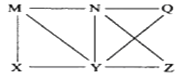
A. Nһ����HCl(aq) B. X����ΪAl��C12
C. Yһ��ΪNaOH(aq) D. Q��Z�е�һ�ֱض�ΪAl2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ø������������Һ����ˮ����������ǣ�������
A.���ͼױ�
B.1����ϩ�Ͷ��ױ�
C.����1����ϩ
D.����ͱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ�ֻ�ͪ�������м��壬��ṹ��ʽ��ͼ��ʾ�������йػ�����X��˵����ȷ����

A. ���л������ʽΪC24H22O5
B. �ܷ���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
C. 1mol������X�������2mol NaOH��Ӧ
D. 1mol������X������11mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�A������H2��B������NH3����ԭ������ȣ��������������������(��)
A.3��2B.1��3C.2��1D.1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����ij±������R��X���е�XԪ�أ�������ʵ��������ټ�����У��ڼ���AgNO3��Һ����ȡ����±�������ܼ���ϡ�����ữ���ݼ���NaOH��Һ������ȴ����ȷ�������Ⱥ�˳���ǣ�������
A.�ۢ٢ݢޢڢ�
B.�ۢ٢ڢޢܢ�
C.�ۢݢ٢ޢܢ�
D.�ۢݢ٢ޢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ�����������ͽ��ͻ���۶���ȷ����
ѡ�� | ʵ����� | ���� | ���ͻ���� |
A | ������Fe���м���ϡHNO3����ַ�Ӧ����KSCN��Һ | ��Һ�ʺ�ɫ | ϡHNO3��Fe����ΪFe3+ |
B |
| ��������Ϊ��ɫ���ұ������Ϊ��ɫ | ������.Cl2>Br2>I2 |
C | �ò�����պȡŨ��ˮ�㵽��ɫʯ����ֽ�� | ��ֽ����ɫ | Ũ��ˮ�ʼ��� |
D | ŨHNO3���� | �к���ɫ���� | HNO3��ǿ������ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com