
【题目】某种熔融碳酸盐燃料电池以Li2CO3和K2CO3为电解质、以CH4为燃料,该电池的工作原理如下图所示,下列说法正确的是
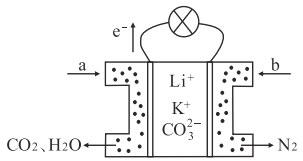
A. 电极a为负极,发生氧化反应 B. CO32-向正极移动
C. 正极电极反应式为O2+2H2O+4e-=4OH- D. 此电池在常温下也能工作
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】把生铁冶炼成碳素钢要解决的主要问题是( )
A.除去生铁中的各种杂质,把生铁提纯
B.适当降低生铁里的含碳量,除去大部分硫、磷等有害杂质
C.用还原剂把铁的氧化物还原成铁
D.加入合金元素改善生铁性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NaF 的水溶液呈__(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____,溶液中含有的各离子浓度从大到小的顺序为______。
(2)AlCl3 水溶液呈__(填“酸”、“中”、“碱”)性,把 AlCl3 溶液蒸干,灼烧,最后得到的主要固体产物是 ______。
(3)CaCl2 溶液与 Na2CO3 溶液混合可形成 CaCO3 沉淀,现将 4×10-4mol/L Na2CO3 溶液与某浓度的 CaCl2溶液等体积混合,则生成沉淀所需 CaCl2 溶液的最小浓度为__ mol·L-1(已知:KSP(CaCO3)=2.8×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s) + 2B(g)![]() C(g) + D(g) 已达到平衡状态‘
C(g) + D(g) 已达到平衡状态‘
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1mol.A、X、E、G、H的焰色反应均为黄色,且H为淡黄色固体.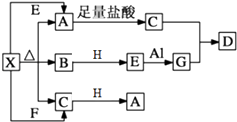
回答下列问题:
(1)写出下列物质的化学式:X , H .
(2)写出E+Al→G反应的化学方程式 , 该反应中氧化剂是 .
(3)写出G溶液中通入过量C制取D的反应离子方程式: .
(4)写出X溶液中滴加过量澄清石灰水反应的离子方程式: .
(5)0.1mol H与足量的C反应,转移的电子数为个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
(1)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 .
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.图表示在其他条件不变时,反应:2CO(g)+2NO(g)2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H0 (填“>”或“<”).
②若催化剂的表面积S1>S2 , 在右图中画出c (NO) 在T1、S2条件下达到平衡过程中的变化曲线 . 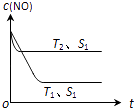
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:![]()
时间/s | 0 | 1 | 2 | 3 | 4 |
c (NO)(×10﹣3 molL﹣1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
c (CO)(×10﹣3 molL﹣1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
不考虑温度变化对催化剂催化效率的影响,按要求完成以下计算(写出计算过程,只写出计算结果的不给分):①计算前2s内的△c (CO2);
②计算前2s内的平均反应速率v (N2);
③计算达到平衡时NO的转化率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() H、
H、 ![]() H、
H、 ![]() H三种核素的性质不同
H三种核素的性质不同
B.16O2、18O2彼此是同位素
C.14N、14C两种核素的中子数相同,质子数不同
D.白磷与红磷是磷元素的两种同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验. 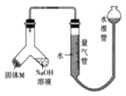
(1)如何检验该装置的气密性?
(2)合金样品固体 M 与氢氧化钠溶液反应的离子方程式是 .
(3)倾斜左边装置使氢氧化钠溶液(足量)与质量为 a 的合金粉末(固体 M)充分反应,待反应停止后,进入量气管气体的体积为 V mL(已折算成标准状况).若量气管最大量 为 50mL,则固体 M 中铝的质量[m(Al)]范围为 .
(4)为了准确地测量氢气的体积,在读取量气管中液面读数的过程中,应注意:①读数时 视线与凹液面最低处相平,②
(5)若 a=38mg,V=44.8mL(标准状况),通过计算可知,该合金中铝的质量分数为(精确到小数点后 1 位).
(6)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积(填“>”“<”或“=”)V.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com