
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 反应体系中混合物的组成保持不变 | D. | 正、逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
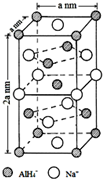 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
.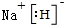 .
. (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体, | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
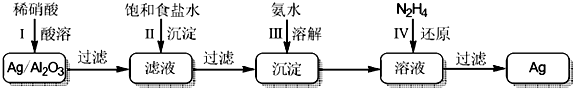
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com