

| A. | a为镁条 | |
| B. | b为氧化铁与铝粉的混合物 | |
| C. | 2 mol氧化剂参与反应则电子转移6 NA个 | |
| D. | 还原剂与氧化产物的物质的量之比为1:2 |
分析 由铝热反应装置可知,a为Mg条,点燃Mg条可引发铝热反应,b为Al与某些金属的氧化物,如氧化铁、二氧化锰、氧化铬等,以此来解答.
解答 解:A.a为镁条,可引发铝热反应,故A正确;
B.b中不一定含氧化铁,铝热反应可冶炼高熔点的金属,故B错误;
C.若发生Al与二氧化锰的反应,则2 mol氧化剂参与反应时电子转移4NA个,故C错误;
D.若发生4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,还原剂与氧化产物的物质的量之比为2:1,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与应用能力的考查,注意铝热剂的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液水解的离子方程式:CO32-+2H2O=H2CO3+2OH- | |
| B. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| C. | 氢氧化钡在水溶液中的电离方程式:Ba(OH)2=Ba2++2OH- | |
| D. | 向含Al(OH)3白色沉淀的溶液中不断通CO2沉淀逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
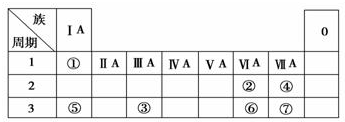
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清的水溶液加饱和(NH4)2SO4溶液后,有白色物质析出 | |
| B. | NO2气体经加压变成无色液体 | |
| C. | 溴水滴入植物油中振荡褪色 | |
| D. | 用SO2漂白的草帽日久变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的氢化物的水溶液酸性比Y的氢化物的水溶液酸性强 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
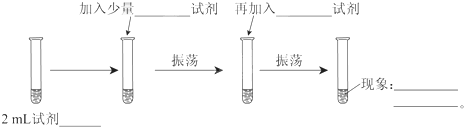
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75% | B. | 80% | C. | 85% | D. | 90% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com