

 ��д���йص����ӷ���ʽ��______��
��д���йص����ӷ���ʽ��______��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
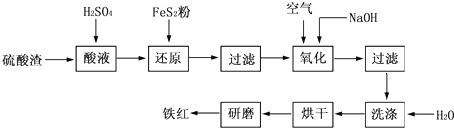
 ��2011?��һģ���Ի�����Ϊԭ������������ķ����к�Fe2O3��SiO2��Al2O3��CaO��MgO�ȣ����Դ˷����Ʊ����죨Fe2O3���Ĺ������£���Ũ��ʱ������������������������ʽ����ʱ��Һ��pH�ɼ�����
��2011?��һģ���Ի�����Ϊԭ������������ķ����к�Fe2O3��SiO2��Al2O3��CaO��MgO�ȣ����Դ˷����Ʊ����죨Fe2O3���Ĺ������£���Ũ��ʱ������������������������ʽ����ʱ��Һ��pH�ɼ�����| ������ | ��ʼ����pH | ������ȫpH |
| Al��OH��3 | 3.0 | 5.2 |
| Fe��OH��3 | 1.5 | 2.8 |
| Fe��OH��2 | 7.6 | 9.7 |
| Mg��OH��2 | 8.0 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ | Fe��OH��3 | Al��OH��3 | Fe��OH��2 | Mg��OH��2 |
| ��ʼ����p H | 2.7 | 3.8 | 7.6 | 9.4 |
| ��ȫ����pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 11 |
| 4 |
| ||
| 1 |
| 2 |
| 11 |
| 4 |
| ||
| 1 |
| 2 |
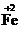 ��
��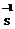
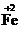 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2- 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ����У�����������������ۻ�ѧ�Ծ��������棩 ���ͣ������
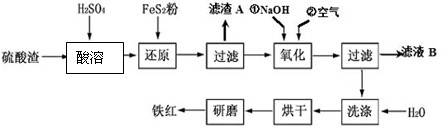
�Ի�����Ϊԭ��������������������к�Fe2O3��SiO2��Al2O3��MgO�ȡ�ʵ����ģ�ҵ���������Ʊ�����(Fe2O3)���������£�
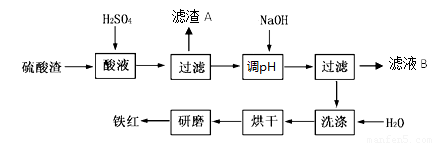
��1���������ijɷ�������������������� �� д�����ܹ���Fe2O3��ϡ���ᷴӦ�����ӷ�Ӧ����ʽ�� ��
��2�����������У�Ϊ��ȷ������Ĵ��ȣ�����������Ҫ������Һ��pH�ķ�Χ��_________��������������������������ʽ����ʱ��Һ��pH���±���
|
������ |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
|
��ʼ���� |
2.7 |
3.8 |
7.5 |
9.4 |
|
��ȫ���� |
3.2 |
5.2 |
9.7 |
12.4 |
��3������A����Ҫ�ɷ�Ϊ ����ҺB���Ի��յ�������______________________��
��4������ϴ�ӹ��̵�ʵ����� ��
��5����֪����������Ϊw kg�����������Ʊ������У���Ԫ�����25%�����յõ����������Ϊm kg����ԭ������������Ԫ����������Ϊ ��������������ʽ��ʾ����
����֪���ԭ��������O 16 S 32 Fe 56 ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com