
(6分)(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用同样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为 。
(2)NO2可用氨水吸收生产硝酸铵,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液中滴加bL氨水后溶液显中性,则滴加氨水的过程中水的电离平衡将会 (填“正向”、“逆向”或“不”) 移动,所滴加氨水的浓度为 mol/L。(已知氨水的电离平衡常数Kb=2×10-5)
(6分) (1) HA、HC、HB、HD (2)NH4++H2O NH3·H2O+H+ ,逆向 ,
NH3·H2O+H+ ,逆向 ,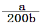
【解析】
试题分析:(1)相同物质的量浓度的NaD和NaB溶液的pH,前者比后大,NaA溶液呈中性,根据越弱越水解,水解后碱性越强可知HB比HD强,但二者都是弱酸,HA的盐不会水解证明是强酸;lmol/l的KC溶液遇酚酞试液呈红色,HC的盐会水解显碱性证明是弱酸;同体积,同物质的量浓度的HB,HC用的装置分别做导电性试验,发现后者的灯泡比前者亮,说明HC的电离程度大于HB的电离程度,HC强于HB,综上所述:HA>HC>HB> HD ;
(2)硝酸铵溶液呈酸性原因是NH4+离子水【解析】
NH4+ + H2O  NH3·H2O + H+,水中存在H2O
NH3·H2O + H+,水中存在H2O  H+ + OH-,当加入铵根离子后,铵根离子与OH-结合形成氨水分子NH4++ OH-
H+ + OH-,当加入铵根离子后,铵根离子与OH-结合形成氨水分子NH4++ OH-  NH3·H2O,消耗的OH-由水分子继续电离提供,因此铵根水解的过程实际上是水分子电离增大的过程,然后向溶液中滴加氨水,由于氨水电离提供的OH-要远大于水电离提供的OH-,这样滴加氨水后,水分子的电离程度是减小的,选“逆向”; 根据氨水电离方程NH3·H2O
NH3·H2O,消耗的OH-由水分子继续电离提供,因此铵根水解的过程实际上是水分子电离增大的过程,然后向溶液中滴加氨水,由于氨水电离提供的OH-要远大于水电离提供的OH-,这样滴加氨水后,水分子的电离程度是减小的,选“逆向”; 根据氨水电离方程NH3·H2O  NH4+ + OH- ,[OH-]=(Kb×[NH3?H2O])/[NH4+],由于溶液体积不管最终是多少,NH4+与NH3?H2O浓度比与其物质的量之比相同,即[OH-]=Kb×n(NH3?H2O)/n(NH4+) , 10-7=2×10-5n(NH3?H2O)/a, 解得 n(NH3?H2O)=a/200,所滴加氨水的浓度为
NH4+ + OH- ,[OH-]=(Kb×[NH3?H2O])/[NH4+],由于溶液体积不管最终是多少,NH4+与NH3?H2O浓度比与其物质的量之比相同,即[OH-]=Kb×n(NH3?H2O)/n(NH4+) , 10-7=2×10-5n(NH3?H2O)/a, 解得 n(NH3?H2O)=a/200,所滴加氨水的浓度为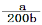 mol/L。
mol/L。
考点:考查弱电解质的电离,盐的水解等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年宁夏回族自治区银川一中高一上期中化学试卷(解析版) 题型:选择题
下列实验操作:①浓硫酸的稀释②称取一定质量的NaOH固体 ③配制100ml0.1mol/l的NaCl溶液④用CCl4萃取碘水的I2⑤用自来水制取蒸馏水,一定要用到玻璃棒的是
A.①②③ B.②③④ C.③⑤ D.①③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏回族自治区银川一中高二上学期期中化学试卷(解析版) 题型:选择题
某反应4A(g)+5B(g)=4C(g)+6D(g),在四种不同情况下的反应速率分别为:
①υ(A)=0.4mol/(L·s);②υ(B)=0.6mol/(L·s);
③υ(C)= 0.8mol/(L·s);④υ(D)=1.0mol/(L·min)。该反应进行得最快的是
A.④ B.③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏高邮市高一上学期期中调研测试化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.在非标准状况下,1 mol O2的体积也有可能是22.4 L
B.在温度和压强一定时,气态物质的体积主要由气体分子数目和分子的大小决定
C.同温同压下,0.3 mol N2和0.7 mol O2的体积比为3∶7
D.同温同压下,相同体积的任何气体所含有的分子数目一定相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可作空军通信卫星的电源,其工作原理如下图所示,

下列说法正确的是
A.每消耗3mol H2O2,转移的电子为3mol
B.电池放电时,Na+从a极区移向b极区
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S)
B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后,溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-)
C.常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-)>c (OH-)= c (H+)
D.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期月考化学试卷(解析版) 题型:选择题
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤
不正确的操作顺序是
A.③②①⑤④ B.②③①⑤④
C.③①②⑤④ D.①②③⑤④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省中山市高二上学期月考化学试卷(解析版) 题型:选择题
下列化合物中,既显酸性又能发生加成反应的是:
A.CH2=CH—CH2OH B.CH3COOH
C.CH2=CH—COOC2H5 D.CH2=CH—COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com