
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
分析 (1)依据二价铁离子与三价铁离子之间转化解答;
(2)FeCl3与KClO在强碱性条件下反应生成K2FeO4,依据得失电子守恒、原子个数守恒书写方程式;
K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应,电极反应Zn-2e-+2OH-=Zn(OH)2;依据产物和电子守恒写出正极反应:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;有正极反应和负极反应合并得到电池反应;
(3)平衡常数表达式等于生成物浓度幂之积除以反应物浓度幂之积,固体与纯液体不代入表达式;
(4)恒容绝热根据反应时温度变化,判断平衡移动,分析氢气的百分含量;
(5)依据氢氧化铁、氢氧化镁溶度积常数计算解答.
解答 解:(1)三价铁离子具有氧化性,能够与铁反应生成二价铁离子,所以在实验室中,FeCl2可用铁粉和氯化铁反应制备;二价铁离子具有还原性,能够被氯气氧化生成三价铁离子,所以FeCl3可用铁粉和 氯气反应制备;
故答案为:盐酸;氯气;
(2)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-;
(3)3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0,反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$;
故答案为:K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$;
(4)由于反应前后气体体积相等,所以C条件下,平衡不移动,氢气的体积分数与平衡是相同;A状况下,反应正向进行生成氢气,反应放出热量使容器温度升高,抑制反应继续生成氢气,故氢气体积分数较低,B状况下反应逆向进行生成Fe和水,是吸热过程,使容器温度降低,抑制反应继续消耗氢气,所以氢气的体积分数较高,故H2的百分含量按由大到小的顺序排列:B>C>A;
故答案为:B>C>A;
(5)pH=4,则[H+]=10-4mol/L,依据[H+][OH-]=10-14,得[OH-]=10-10mol/L,
Qc[(Mg(OH)2]=0.1mol/L×(10-10mol/L)2=10-21(mol/L)2,Qc<Ksp[Mg(OH)2],镁离子未沉淀,则镁离子浓度C=0.1mol/L;
Qc[Fe(OH)3]=0.1mol•L-1×(10-10mol/L)3=10-31(mol/L)3,Qc[Fe(OH)3]>Ksp[Fe(OH)3],则溶液中三价铁离子浓度C(Fe3+)=$\frac{Ksp}{C{\;}^{3}(OH{\;}^{-})}$=$\frac{1.0×1{0}^{-39}}{(1{0}^{-}{\;}^{10}){\;}^{3}}$=1.0×10-9mol/L;
则:则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为$\frac{0.1}{1{0}^{-9}}$=108,
故答案为:108.
点评 本题为综合题,考查了不同价态铁元素之间转化,化学平衡常数表达式书写、有关溶度积常数计算,题目难度较大,准确把握化学平衡理论是解题关键.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L Na2C2O4中:2c(Na+)═c(C2O42- )+c(HC2O4-)+c(H2C2O4) | |
| B. | 浓度均为0.1mol/L的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c〔HCO3-) | |
| C. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| D. | 0.2mol/L NaHCO3与0.1mol/L KOH溶液等体积混合:c(Na+)═2c(CO32-)+c〔HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极反应式为Cn[AlCl4]+e-═[AlCl4]-+Cn | |
| B. | 充电时,阴极反应式为4[Al2Cl7]-3e-═Al+7[AlCl4]- | |
| C. | 放电过程中,负极每消耗1mol Al,导线中转移的电子数为3NA(NA为阿伏伽德罗常数的值) | |
| D. | 充、放电过程中,R+的移动方向相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ②③⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
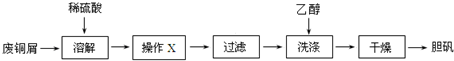
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量食用纯碱可使钙离子沉淀完全,预防胆结石产生 | |
| B. | 不食用含钙的食品 | |
| C. | 适量服用维生素E、维生素C等抗氧化自由基可预防胆结石 | |
| D. | 手术切除胆囊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol.L-1 NaOH溶液:K+、SO42-、CO32- | |
| B. | 0.1 mol.L-1 NaOH溶液:NH4+、Cl-、HCO3 - | |
| C. | PH=1的溶液中:Fe2+、NO3 -、Ba2+ | |
| D. | 0.1 mol.L-1 Na2CO3溶液:Ca2+、NO3 -、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com