
| 药品柜 | 甲 | 乙 | 丙 | 丁 |
| 药品 | 硫黄、红磷 | 镁、锌 | 硫酸、硝酸 | 氢氧化钠、氢氧化钙 |
| A. | 甲柜 | B. | 乙柜 | C. | 丙柜 | D. | 丁柜 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
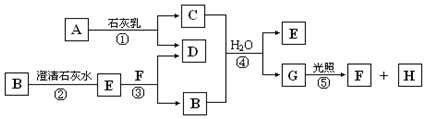 图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).
图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,活化分子数增加,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能、反应速率加快,但是活化分子百分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在轮船水线以下的船体装上一定数量的锌块 | |
| B. | 在金属表面进行电镀 | |
| C. | 在一定条件下对金属进行处理,在其表面形成一层致密的氧化膜 | |
| D. | 将铁闸门与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
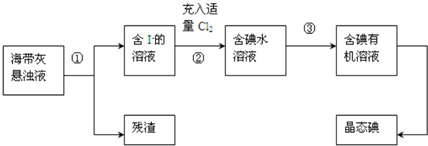
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、Na2CO3、NaOH、盐酸 | B. | NaOH、BaCl2、Na2CO3、盐酸 | ||
| C. | Na2CO3、NaOH、BaCl2、盐酸 | D. | BaCl2、NaOH、Na2CO3、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
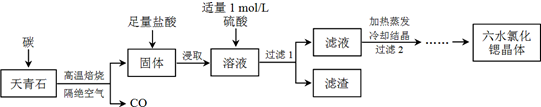
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com