
| A. | 烧碱 NaOH | B. | 碱石灰 CaO | C. | 纯碱 Na2CO3 | D. | 小苏打 NaHCO3 |
科目:高中化学 来源: 题型:解答题
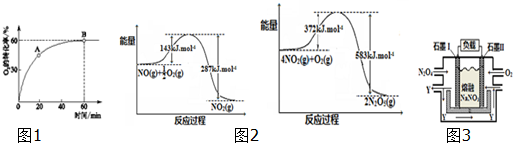
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中熵变小于0、焓变大于0 | |
| B. | 判断反应能否自发进行需要根据△H与△S综合考虑 | |
| C. | 该反应是吸热反应,因此一定不能自发进行 | |
| D. | 碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
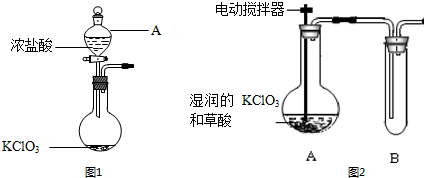

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | H2S的燃烧热△H=-a kJ•mol-1,则表示H2S燃烧热的热化学方程式为2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-2a kJ•mol-1 | |
| D. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com