
| A. | 0.2 mol•L-1CH3COONa溶液和0.1 mol•L-1HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | pH=3的盐酸和NaOH的混合溶液中:c(Na+)=c(Cl-) | |
| C. | 0.1 mol•L-1NaHCO3 溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 含SO42-、NH4+、H+、OH-的溶液中可能存在:c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
分析 A、0.2 mol•L-1CH3COONa溶液和0.1 mol•L-1HCl溶液等体积混合后得到等浓度的氯化钠、醋酸钠和醋酸的混合物;
B、pH=3的盐酸和NaOH的混合溶液中:c(H+)>c(OH-),根据电荷守恒来回答;
C、根据溶液中的电荷守恒来回答;
D、含SO42-、NH4+、H+、OH-的溶液中可能是硫酸和硫酸氢铵的混合物.
解答 解:A、0.2 mol•L-1CH3COONa溶液和0.1 mol•L-1HCl溶液等体积混合后得到等浓度的氯化钠、醋酸钠和醋酸的混合物,溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故A错误;
B、pH=3的盐酸和NaOH的混合溶液中:c(H+)>c(OH-),根据电荷守恒,所以c(Na+)<c(Cl-),故B错误;
C、0.1 mol•L-1NaHCO3 溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D、含SO42-、NH4+、H+、OH-的溶液中可能是硫酸和硫酸氢铵的混合物,此时c(H+)>c(SO42-)>c(NH4+)>c(OH-),故D正确.
故选D.
点评 本题考查学生溶液中离子浓度大小关系知识,注意电荷守恒的灵活应用是重点,难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯的实验式:C4H6 | B. | 乙醇的分子式:C2H5OH | ||
| C. | 甲醛的结构式: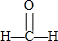 | D. | 聚丙烯的结构简式: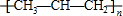 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸清洗做焰色反应的铂丝 | |
| B. | 金属钠保存在煤油中 | |
| C. | 用丁达尔现象区别溶液与胶体 | |
| D. | 除去粗盐溶液中的Ca2+、SO42-:先加Na2CO3溶液后加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
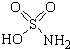 氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )
氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )| A. | 不溶于水 | B. | 不能清洗铁锈 | ||
| C. | 水溶液中以分子形式大量存在 | D. | 与水反应生成的盐是NH4HSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com