
| A. | 用磷酸钙陶瓷制造人体骨骼,利用的是该材料的耐高温功能 | |
| B. | 氨气具有氧化性,用浓氨水检验氯气管道是否泄漏 | |
| C. | 碳酸钠溶液显碱性,可用热的饱和碳酸钠溶液除去金属表面的油污 | |
| D. | 工业生产玻璃、水泥、陶瓷都要使用石灰石做原料 |
分析 A.制造人体骨骼,具有生物功能;
B.用浓氨水检验氯气管道是否泄漏,氨气与氯气反应生成氮气和氯化铵,冒白烟;
C.热的饱和碳酸钠溶液,促进水解,碱性增强,且碱性条件下利用油污的水解;
D.玻璃、水泥均使用石灰石,陶瓷的原料为黏土.
解答 解:A.制造人体骨骼,具有生物功能,与耐高温功能无关,故A错误;
B.用浓氨水检验氯气管道是否泄漏,氨气与氯气反应生成氮气和氯化铵,冒白烟,与氨气的还原性有关,故B错误;
C.水解为吸热反应,热的饱和碳酸钠溶液,促进水解,碱性增强,且碱性条件下利用油污的水解,则用热的饱和碳酸钠溶液除去金属表面的油污,故C正确;
D.陶瓷的原料为黏土,不需要石灰石,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
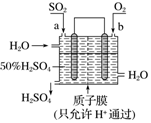
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol N2所含有的原子数为NA
B.标准状况下,22.4 L水中含有的水分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石中含σ键数为4 NA | |
| B. | 1mol Na2O2固体中含离子总数为4 NA | |
| C. | ag C2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{14}$ | |
| D. | 30g甲醛中含π键数为NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与 体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
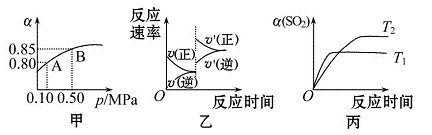
A.由图甲知,B点SO2的平衡浓度为0.3mol·L-1
B.由图甲知,A点对应温度下的平衡常数为80
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com