
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。
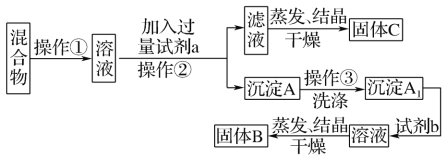
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。试回答下列问题:
(1)操作①的名称是____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是____。
(3)加入试剂a所发生反应的化学方程式为_____。加入试剂b所发生反应的离子方程式为_____。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
【答案】溶解 过滤 K2CO3 HCl BaCl2 K2CO3+BaCl2=BaCO3↓+2KCl Ba2++2H+=Ba2++CO2↑+H2O 不能 应在操作②的滤液中加入过量盐酸后再蒸发结晶
【解析】
KCl和BaCl2两种固体混合物加水溶解得到两者混合溶液,加过量K2CO3溶液得BaCO3沉淀,再加稀盐酸,得氯化钡溶液蒸发结晶可得氯化钡固体,滤液中含KCl和K2CO3,据此回答。
(1)KCl和BaCl2两种固体混合物加水溶解得到两者混合溶液,故操作①为溶解,加过量K2CO3溶液得BaCO3沉淀和滤液,故操作②为过滤。
故答案为:溶解;过滤;
(2)试剂a是K2CO3溶液;试剂b是稀盐酸,与Ba2CO3反应生成BaCl2;固体B是BaCl2。
故答案为:K2CO3;HCl;BaCl2;
(3)加入试剂a所发生反应的化学方程式为:K2CO3+BaCl2=BaCO3↓+2KCl;加入试剂b所发生反应的离子方程式为Ba2++2H+=Ba2++CO2↑+H2O。
故答案为:K2CO3+BaCl2=BaCO3↓+2KCl;Ba2++2H+=Ba2++CO2↑+H2O;
(4)由于滤液中含有过量得K2CO3,故滤液直接蒸发结晶后不能得到纯净的KCl,需先加入过量盐酸后再蒸发结晶。
故答案为:不能;应在操作②的滤液中加入过量盐酸后再蒸发结晶。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根据上述情况判断:
2PbSO4(s)+2H2O(l)。根据上述情况判断:
(1)放电时,电解质溶液的pH________(填“增大”“减小”或“不变”)。
(2)放电时,电解质溶液中阴离子移向_____极,电子从_____极流向____极。
(3)写出负极的电极方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)是一种重要的化工产品,工业上可用甲醇脱氢法制备,相关反应方程式为:CH3OH(g) ![]() HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
(1)反应过程中需要向体系中通入空气,通过以下反应提供上述反应所需要的热量:H2(g)+![]() O2(g)=H2O(g) △H=-bkJ/mol
O2(g)=H2O(g) △H=-bkJ/mol
要使反应温度维持在650℃,则进料时,甲醇和空气的体积比应为___(已知空气中氧气的体积分数为20%,b>a)。
(2)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH30H→H+CH2OH(H叫做氢自由基,实际上就是H原子,有很高的反应活性,
“”代表有一个单电子可以参与配对成键)
历程ii:CH2OH→H+HCHO
历程iii:CH2OH→3H+CO
历程iv:自由基发生碰撞形成新化学键而湮灭
如图1所示为在体积为2L的恒容容器中,投入1molCH3OH(g),在碳酸钠催化剂作用下开始反应,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(副反应仅考虑CH3OH![]() CO+2H2):
CO+2H2):
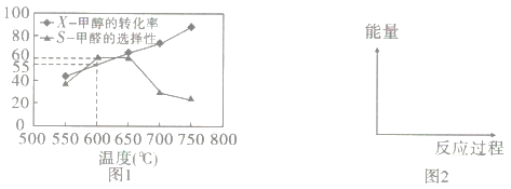
①请在图2所给坐标中,画出历程iv的反应过程一能量变化示意图___。
②下列说法合理的是__。
a.升高温度,甲醇转化率提高,平衡常数变大
b.当体系气体密度保持不变时,达到平衡状态
c.及时分离产品有利于提高甲醇生成甲醛的转化率
③600℃时,前20min甲醇的平均反应速率为__,此时生成甲醛的反应的Qp=___(Qp的表达式与平衡常数Kp相同,p为物质的分压,分压=总压×物质的量分数,体系初始压强为P0)
④650℃以后,甲醛的选择性降低,而甲醇的转化率升高的可能原因是___。
(3)氧化剂可处理甲醛污染,结合以下图像分析夏季(水温约20℃)应急处理甲醛污染的水源最好应选择的试剂为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则混合气体中CO2、H2和CO的体积比为( )
A.29:8:13B.22:1:14C.13:8:29D.26:8:57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
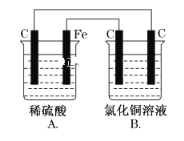
A.A为原电池
B.B为电解池
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
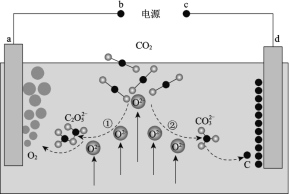
下列说法不正确的是
A.c为电源的负极
B.①②中,捕获CO2时碳元素的化合价均未发生变化
C.d极的电极反应式为![]() + 4e = C + 3O2
+ 4e = C + 3O2
D.转移1mol电子可捕获CO2 2.8 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
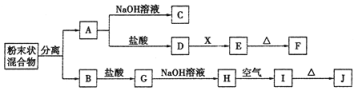
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
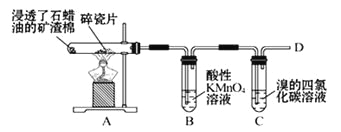
①A中碎瓷片的作用是______________。
②B中反应类型是______________。C中实验现象是__________________________。
③在D处点燃前必须进行的操作是___________________________。
(2)制取氯乙烷(CH3CH2Cl)的最佳方法是(用化学方程式表示):________________。
(3)来自石油的另一产品是苯,请写出由苯制硝基苯的化学方程式:_______________。
(4)该实验中D处乙烯燃烧的化学方程式:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com