

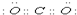 ,
,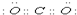 ;
;
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、汽车尾气中含有污染空气的氮氧化物,原因是汽油燃烧不充分 |
| B、清晨,日出后的密林中可看到缕缕光束,这与胶体的性质有关 |
| C、消除“白色污染”可以采用焚烧、填埋的方法 |
| D、钢铁在潮湿的空气中容易生锈,是因为形成了原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3+H2O=H2SO4 |
| B、Zn+2HCl=ZnCl2+H2↑ |
| C、Fe+CuSO4=FeSO4+Cu |
| D、KCl+AgNO3=KNO3+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
- 3 |
- 3 |
- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应前 | 反应前 | 平衡时 |
| n(PCl3)=4.0mol | n(Cl2)=2.0mol | n(PCl5)=0.80mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com