
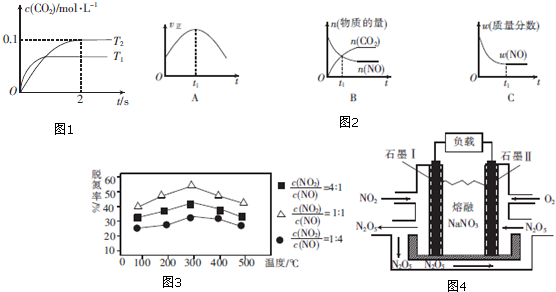
分析 (1)①根据到达平衡的时间判断温度高低,根据平衡时二氧化碳的浓度判断温度对平衡的影响,进而判断△H;
②由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(N2);
③a、到达平衡后正、逆速率相等,不再变化;
b、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d、到达平衡后各组分的含量不发生变化;
(2)根据纵坐标判断,相同温度下,脱氢率越高的效果越好,脱氮反应是氨气和二氧化氮、一氧化氮发生氧化还原反应生成氮气和水;
(3)据题意电池总反应4NO2+O2=2N2O5,通入气体判断两极,二氧化氮一端为原电池的负极上发生氧化反应,氧气一端电极为原电池正极,据此书写电极反应;
解答 解:(1)①由图1可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.2mol/L,故v(CO2)=$\frac{0.2mol/L}{2s}$=0.1mol/(L•s),速率之比等于化学计量数之比,故v(N2)=$\frac{1}{2}$v(CO2)=$\frac{1}{2}$×0.1mol/(L•s)=0.05mol/(L•s),
故答案为:0.05mol/(L•s);
③a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确,
c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确;
故答案为:bd;
(2)根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好,脱氮反应是氨气和二氧化氮、一氧化氮发生氧化还原反应生成氮气和水,反应的化学方程式:2NH3+NO+NO2?2N2+3H2O,
故答案为:1:1,2NH3+NO+NO2?2N2+3H2O;
(3)据题意,通O2一极为正极,电极反应式为O2+2N2O5+4e-=4NO3-,通NO2一极为负极,电极反应为:NO2+NO3--e-=N2O5,
故答案为:NO2+NO3--e-=N2O5.
点评 本题考查较综合,涉及图象分析、热化学、电化学知识等,注意图象分析中的曲线的变化趋势,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L CCl4所含的分子数为0.5 NA | |
| B. | 常温常压下,4.2 g C2H4和C8H16的混合物中含有的碳原子数为0.3 NA | |
| C. | 7.8 g苯分子中碳碳双键的数目为0.3 NA | |
| D. | 6.4 g Cu与20 mL 10 mol•L-1浓硫酸反应,转移的电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 常温下,V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 | |
| C. | 在0.1mol•L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大 | |
| D. | 反应2NO2(g)?N2O4(g)△H<O,升高温度该反应平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有4种官能团 | |
| B. | 分子式为C10H8O6 | |
| C. | 1mol分枝酸最多可与2mol乙醇发生酯化反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
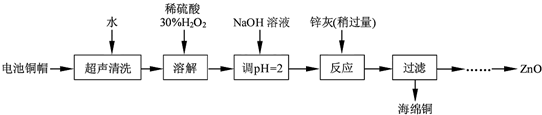
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com