
| A. | NaOH | B. | Na2CO3 | C. | Ca(OH)2 | D. | NaHCO3 |
分析 工业上制取氯气大多采用电解饱和食盐水的方法,以此为基础的工业称为“氯碱工业”,电解饱和食盐水可产生氯气、氢气和氢氧化钠,据此分析进行解答.
解答 解:电解饱和食盐水阳极氯离子失去电子,化合价从-1价变化为0价,发生氧化反应,电极反应为:2Cl--2e-═Cl2↑,阴极氢离子得到电子,氢元素化合价从+1价变化为0价,发生还原反应,电极反应为:2H++2e-═H2↑,总反应为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,氯碱工业制备的碱是氢氧化钠,
故选A.
点评 本题考查了氯碱工业,掌握电解原理是解答的关键,题目难度不大,注意物质的类别是关键.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1 mol NH3含有的电子数10NA | |
| C. | 常温常压下,22.4 L的氧气含氧原子数为2NA | |
| D. | 常温下,1 L0.1 mol•L-1AlCl3溶液中含Al3+数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1 L pH=12的氨水溶液中含有0.01NA个NH4+ | |
| B. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| C. | 常温常压下,11.2L O2和O3的混合气体含有0.5NA个分子 | |
| D. | 78g Na2O2固体中含有离子总数必为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀盐酸:Ba(OH)2+2H+═Ba2++2H2O | |
| B. | 碘化钠溶液和溴水反应:I-+Br2═I2+Br- | |
| C. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 实验室用浓盐酸和MnO2制Cl2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
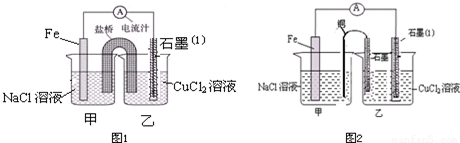
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 3mol/LKCl溶液 | B. | 75mL 2mol/LMgCl2溶液 | ||
| C. | 100mL1mol/LNaCl溶液 | D. | 50mL 3mol/LAlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com