
【题目】下列说法正确的是
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 含有金属阳离子的晶体一定是离子晶体
D. 元素的非金属型越强,其单质的活泼性一定越强
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应 3X(g)+Y(g)nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01molL﹣1min﹣1 , 则 n是( )
A.2
B.4
C.1
D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
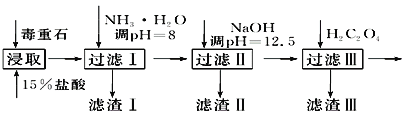
(1)毒重石用盐酸浸取前需充分研磨,目的是_______________________________________;实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)查阅有关资料获得沉淀各种杂质离子的pH见下表:
沉淀杂质离子 | Ca2+ | Mg2+ | Fe3+ |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去______(填离子符号);滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9)。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ.准确移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入几滴酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ.准确移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(选填“上方”或“下方”)。BaCl2溶液的浓度为________________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则所测得Ba2+浓度测量值将________(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锂离子电池的回收利用的意义重大,其正极废料的主要成分是LiCoO2、铝、炭黑及其他杂质,回收利用的流程如下:

已知“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
(1)步骤①中铝溶解的离子方程式为_________________,固体X的成分是_________。
(2)步骤②中LiCoO2固体溶解的化学方程式为_______________ ,该反应的还原剂是_______。
(3)母液中含量最大的三种离子是_________。
(4) (NH4)2C2O4是一种化学实验室常用的试剂,预测其溶解性___________(填“可溶于水”或“不溶于水”)。一定温度下,(NH4)2C2O4固体可分解出NH3和CO等物质,思考其它的产物并写出其分解的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素构成的双原子单质分子有三种,其式量分别为158、160、162.在天然单质中,此三种单质的物质的量之比为1:1:1,由此推断以下结论中,正确的是( )
A.此元素有三种同位素
B.其中一种同位素质量数为80
C.其中质量数为79的同位素原子占原子总数的 ![]()
D.此元素的单质的平均式量为160
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下使其反应:H2(g)+I2(g)![]() 2HI(g) △H<0.
2HI(g) △H<0.
(1)保持容器的容积不变,向其中加入1mol H2,反应速率_____(填“加快”“减慢”“无影响”), 理由是_______________________________________________________________.
(2)保持容器的容积不变,向其中加入1molN2(不参与反应),反应速率______.(填“加快”“减慢”“无影响”) 理由是________________________________________________.
(3)保持容器内气体的压强不变,向其中加入1mol N2(不参与反应),反应速率____.(填“加快”“减慢”“无影响”) 理由是_____________________________________________.
(4)保持容器内气体的压强不变,向其中加入1mol H2和1mol I2(g),反应速率______.(填“加快”“减慢”“无影响”) 理由是____________________________________________.
(5)提高起始的反应温度,反应速率______.(填“加快”“减慢”“无影响”) 理由是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%的酒精溶液(P<1)
B. 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5mol·L-1
C. 实验中需用2.0mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分数分别为950mL、201.4g
D. 实验室配制500mL 0.2mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO47H2O),放入小烧杯中加水溶解,转移到500mL容量瓶、稀释、定量、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境保护的说法中错误的是( )
A. 研制开发燃料电池汽车,消除机动车尾气污染
B. 加大石油、煤炭的开采速度,增加化石燃料的供应量
C. 含甲醛、苯及其同系物的装修材料对人体有害
D. 随意丢弃废旧电池会造成重金属盐对土壤和水源的污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com