
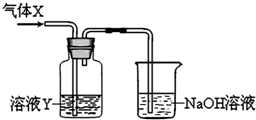
���� ��1��������ǿ�����ԣ��ܰ�I-�����������ɵⵥ�ʣ��ⵥ���������۱���ɫ��
a��������NaOH��Һ��Ӧ��Ԫ�ػ��ϼ�0�۱仯Ϊ-1�ۺ�+1�ۣ�
b������������ʯ�ҷ�Ӧ�����Ȼ��ƺʹ�����ƣ�������ȡƯ�ۣ�
c��������ˮ��Ӧ��������ʹ����ᣬ��ʹ��ɫʯ����Һ�ȱ�����ɫ��
��2��������XΪ�������ҺYΪ��ˮ����ɹ۲쵽Y��Һ��ɫ��ȡ������ɫ�����Һ�μ��Ȼ�����Һ������ɫ����˵��Ϊ���ᱵ������֤��XΪSO2������������л�ԭ�Ա��嵥������Ϊ���ᣬװ��������������Һ���ն���Ķ�������ֹ��Ⱦ������
��� �⣺��1��������ǿ�����ԣ��ܰ�I-�����������ɵⵥ�ʣ�Cl2+2I-=I2+2Cl-���ⵥ���������۱���ɫ���ɹ۲쵽��ҺY�е�ʵ����������Һ����ɫ��
a��������NaOH��Һ��Ӧ��Cl2+2NaOH=NaCl+NaClO+H2O��Ԫ�ػ��ϼ�0�۱仯Ϊ-1�ۺ�+1�ۣ���������������Ҳ����ԭ������a����
b������������ʯ�ҷ�Ӧ�����Ȼ��ƺʹ�����ƣ�2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O���õ����Ȼ��ƺʹ������ΪƯ�۵ijɷ֣�������ȡƯ�ۣ���b��ȷ��
c��������ˮ��Ӧ��������ʹ����ᣬCl2+H2O=HCl+HClO�������������������ʹ��ɫʯ����Һ���ɫ�����ɵĴ��������Ư����ʹ���ɫ��ʯ����Һ��ɫ����������Ϊʹ��ɫʯ����Һ�ȱ�����ɫ����c��ȷ��
�ʴ�Ϊ����Һ����ɫ��bc��
��2��������XΪ�������ҺYΪ��ˮ����ɹ۲쵽Y��Һ��ɫ��ȡ������ɫ�����Һ�μ��Ȼ�����Һ������ɫ����˵��Ϊ���ᱵ������֤��XΪSO2������������л�ԭ�Ա��嵥������Ϊ���ᣬSO2+Br2+2H2O=2HBr+H2SO4��H2SO4+BaCl2=BaSO4��+2HCl��װ��������������Һ���ն���Ķ�������ֹ��Ⱦ������SO2+2NaOH=Na2CO3+H2O��
�ʴ�Ϊ��SO2��SO2+2NaOH=Na2CO3+H2O��
���� ���⿼�������������������仯��������ʷ���Ӧ�ã���Ӧ������ͷ�Ӧ�����ж��ǽ���ؼ���ע��������Ư���ԣ���������Ļ�ԭ�����գ���Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼���ƿ�������ĭ���� | B�� | ����������ˮ�� | ||
| C�� | ������������ˮ������ | D�� | ���ȷ�Ӧ���������Ӹֹ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
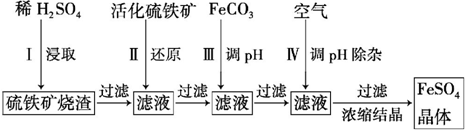
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
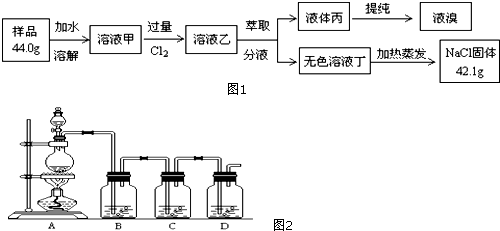
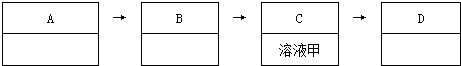
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������c��Na+����c��OH-��=c��CH3COO-����c��H+�� | |
| B�� | �����������c��OH-��-c��H+��=c��Na+��-c��CH3COO-�� | |
| C�� | ������10.0 mLNaOH��Һʱ�У�c��CH3COOH��-c��CH3COO-���T2[c��OH-��-c��H+��] | |
| D�� | ������10.0 mLNaOH��Һʱ�����Һ��pH=4.75����c��CH3COO-����c��CH3COOH����c��Na+����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
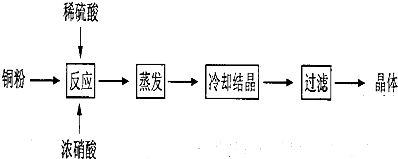
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 22.4LO2���е�O2���Ӹ���ΪNA | |
| B�� | �ڱ�״���£�4.48L H2O��������ԭ������Ϊ0.6NA | |
| C�� | 40 g NaOH�ܽ���1 Lˮ�У����Ƶõ���Һ�����ʵ���Ũ��Ϊ1mol•L-1 | |
| D�� | ���³�ѹ�£�22g CO2���е�ԭ�Ӹ���Ϊ1.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
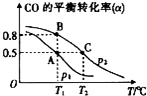 SO2��NO��NO2��CO������Ⱦ�������к����ʣ�������л��������ǽ��ܼ��ŵ���Ҫ���⣮
SO2��NO��NO2��CO������Ⱦ�������к����ʣ�������л��������ǽ��ܼ��ŵ���Ҫ���⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=11��Na2SO3��Һ�У�ˮ�����c��H+��=1.0��10-11mol/L | |
| B�� | ��0.2mol•L-1������0.1mol•L-1��KAlO2��Һ�������ϣ���Һ������Ũ����С�����˳��c��OH-����c��Al3+����c��H+����c��K+����c��Cl-�� | |
| C�� | Ũ����ͬ�Ģ�NH4Cl�ڣ�NH4��2SO4�ۣ�NH4��2CO3��NH4HSO4������Һ��c��NH4+����С˳��Ϊ���ڣ��ۣ��ܣ��� | |
| D�� | pH=4��NaHC2O4��Һ�д��ڣ�c��Na+��+c��H+��=c��OH-��+c��HC2O4-��+c��C2O42-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com