
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. “84”消毒液中:SiO32-、CO32-、Na+、K+
B. ![]() 的溶液中NH4+、Ca2+、C1-、NO3-
的溶液中NH4+、Ca2+、C1-、NO3-
C. 0.1mol/LNaA1O2溶液中:HCO3-、NH4+、SO32-、Fe3+
D. pH=1的溶液中:Na+、K+、Cl-、S2O32-
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是

A. X、Y为曲线两交叉点。由X点处的pH,可计Ka1(H2S)
B. Y点对应溶液中c(Na+)与含硫各微粒浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C. X、Y点对应溶液中水的电离程度大小关系为:X > Y
D. 已知NaHS呈碱性,若向溶液中加入CuSO4溶液至恰好完全反应,所得溶液呈强酸性。其原因是Cu2++HS-=CuS↓+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃在氧气中完全燃烧,生成物先通过浓硫酸,再通过碱石灰,如果生成物完全全被二者吸收,浓硫酸增重27g,碱石灰增重44g。该有机物的化学式为
A.CH4B.C2H6C.C3H8D.C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为
A. 188 kJB. 557 kJC. 920 kJD. 436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝不滴落下来 | 氧化铝的熔点高于铝的熔点 |
C | 常温下,用pH计测0.1mol/LNaX溶液和0.1mol/LNa2CO3溶液的pH | 前者小于后者 | 酸性:HX>H2CO3 |
D | 向10%的蔗糖溶液中加入少量稀硫酸,水浴加热一段时间,再加入银氨溶液 | 未出现光亮银镜 | 蔗糖未发生水解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注。它有如下转化关系,下列说法正确的是( )
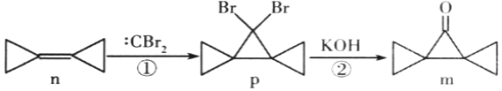
A. n的所有原子都在一个平面内B. 反应②是消去反应
C. n与![]() 互为同分异构体D. m的同分异构体中属于芳香族化合物的共有四种
互为同分异构体D. m的同分异构体中属于芳香族化合物的共有四种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com