
全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色。下列叙述正确的是( )
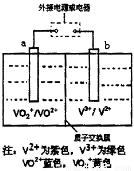
A.充电时右槽溶液颜色由紫色变为绿色
B.放电时,b极发生还原反应
C.电池的总反应可表示为VO2++V2++2H+ VO2++V3++H2O
VO2++V3++H2O
D.充电过程中,a极的反应式为VO2++2H++e-═VO2++H2O
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2015-2016学年广西河池高中高一下第二次月考化学试卷(解析版) 题型:选择题
近年来,广州市的大部分公交车及部分出租车己采用LPG (液化石油气)作为汽车的燃料,其主要目的是( )
A.防止石油短缺 B.降低成本 C.减少对大气的污染 D.加大发动机的动力
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:填空题
Ⅰ、按要求书写下列化学方程式和名称:
(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成
(2)甲苯制备TNT ,用系统命名给TNT命名
(3)乙醛发生银镜反应
Ⅱ、(1)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则此烯烃可能的结构简式是: (任写一种)。
(2)核磁共振谱表明A分子中只有一种类型的氢。
①用系统命名法给A命名: 。
②A中的碳原子是否都处于同一平面? (填“是”或者“不是”)。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:填空题
【选做题】本题包括A, B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分
A.在5-氨基四唑(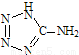 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
(1)基态Ga原子的电子排布式可表示为____________;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为____________,其中N原子的杂化类型为____________;在1mol 5-氨基四唑中含有的σ键的数目为____________。
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为____________。
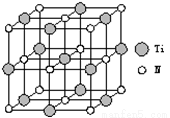
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O) > c(NH4+)> c(Cl-)> c(OH-)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1 mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: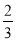 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15, X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
C.XZ2, X2M2, W2Z2均为直线型的共价化合物
D.由X元素形成的单质不一定是原子晶体
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:填空题
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)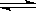 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见右图,图中曲线a表示H2S的平衡转化率与温度关系,曲线表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H______0,(“>”、“<”或“=”),
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:______。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
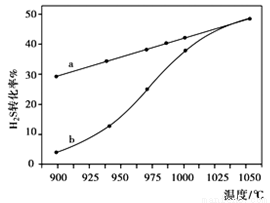
①计算反应C(s)+2H2O(g)+CaO(s)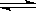 CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
A.降低体系的温度
B.压缩容器的体积
C.适当增加水蒸气的通入量
D.增加CaO的量
③下图为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。

查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:选择题
下列有关实验操作及原理正确的是( )
A.用玻璃棒蘸取NaClO溶液,点在干燥的pH试纸上,证明HClO是弱酸。
B.将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液
C.将Cu与浓硫酸反应剩余的液体加入到盛有蒸馏水的烧杯中,以证明反应生成了CuSO4
D.用乙醇、乙酸制取乙酸乙酯的过程中发现忘加碎瓷片,可立即补加
查看答案和解析>>
科目:高中化学 来源:2016届山西省等校高三下第四次联考理综化学A卷(解析版) 题型:选择题
锂—铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
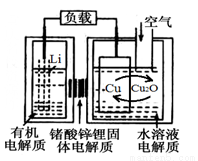
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com