
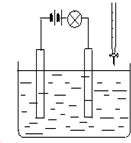
 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 醋酸中逐渐加入氢氧化钠溶液 |
分析 若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,说明溶液中电解质的浓度降低,说明所加入物质能与溶液中电解质反应生成弱电解质或沉淀,至熄灭后又逐渐变亮,说明完全反应时溶液电荷浓度接近0,当另一溶液过量时,溶液中电荷浓度逐渐增大,又逐渐变亮.
解答 解:A.HCl是强电解质,在水溶液里完全电离,加入NaCl后,二者不反应,溶液中电荷浓度不是0,所以不熄灭,故A错误;
B.硫酸和NaOH都是强电解质,二者发生反应H2SO4+2NaOH=Na2SO4+H2O,生成的硫酸钠是强电解质,溶液中离子浓度减小,所以灯泡变暗,但不熄灭,故B错误;
C.硫酸和氢氧化钡都是强电解质,二者发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,反应后生成难溶物和弱电解质,溶液中离子浓度逐渐减小,所以灯泡变暗,二者恰好反应时离子浓度最小,灯泡熄灭,再继续滴加氢氧化钡,溶液中离子浓度增大,灯泡变亮,符合题意,故C正确;
D.醋酸、一水合氨都为弱电解质,二者反应生成醋酸铵,溶液导电性增强,不存在熄灭的现象,故D错误.
故选C.
点评 本题考查电解质的电离及离子反应,明确溶液导电性与离子浓度关系是解本题关键,溶液导电性与离子浓度、电荷有关,与电解质强弱无关,为易错点.


科目:高中化学 来源: 题型:解答题
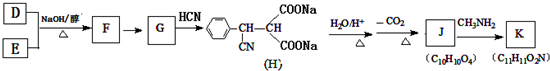
 ,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.
,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.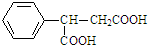 +CH3NH2$\stackrel{一定条件下}{→}$
+CH3NH2$\stackrel{一定条件下}{→}$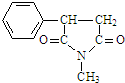 +2H2O.
+2H2O.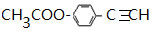 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中 c(H2CO3)>c(CO32-) | |
| B. | 常温下,该溶液的pH>7 | |
| C. | 该溶液中阳离子总数小于阴离子总数 | |
| D. | 常温下,加水稀释时$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
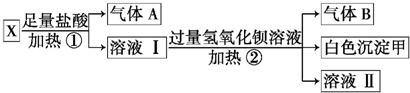
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 实验室制氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| C. | 稀硫酸中加氢氧化钡到溶液呈中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| D. | 氢氧化钠溶液中吸收少量二氧化硫:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
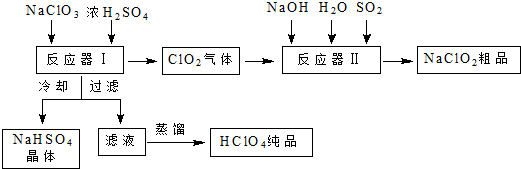
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com