
| A�� | CH3OH��ȼ���ȣ���H��Ϊ-192.9kJ•mol-1 | |
| B�� | 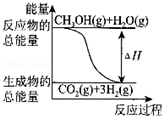 ��Ӧ���е������仯��ͼ��ʾ | |
| C�� | CH3OHת���H2�Ĺ���һ��Ҫ�������� | |
| D�� | ���ݢ���֪��Ӧ��CH3OH��l��+O2��g���TCO2��g��+2H2��g���ġ�H��-192.9kJ•mol-1 |
���� A�����ø�˹���ɣ��ڡ�3-�١�2�ɵü״�ȼ�յ��Ȼ�ѧ����ʽ��������֪�״���ȼ���ȣ�
B�����ݡ�H=������������-��Ӧ�����������жϣ�
C��������֪�ļ״�ת��Ϊ���������ַ�Ӧԭ�����жϣ�
D���������ʵ�������С�����ʵ�״̬��ϵ���жϣ�
��� �⣺A�����ݸ�˹���ɽ����ڡ�3-�١�2�ɵã�CH3OH��g��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-192.9kJ/mol��3-49kJ/mol��2=-676.7kJ/mol�����Լ״���ȼ����Ϊ676.7kJ/mol����A����
B����Ӧ�ٵġ�H��0����ͼʾ�ġ�H=������������-��Ӧ����������0����B����
C������֪��֪����Ӧ��Ϊ���ȷ�Ӧ������Ӧ��Ϊ���ȷ�Ӧ����C����
D��ͬ���ʵ�����ͬ�����ʣ���̬������ߣ����Һ̬��������̬������ͣ��ɢ���֪��Ӧ��CH3OH��l��+$\frac{1}{2}$O2��g��=CO2��g��+2H2��g���ġ�H��-192.9kJ•mol-1����D��ȷ��
��ѡD��
���� ���⿼�黯ѧ��Ӧ�ķ�Ӧ�ȵļ��㣮ע���ڱȽϷ�Ӧ�ȴ�СʱҪ�����űȽϣ���ע���˹���ɵ�Ӧ�������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
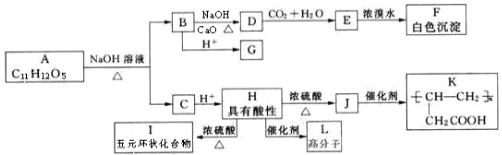
 +NaOH $��_{��}^{CaO}$R-H+Na2CO3
+NaOH $��_{��}^{CaO}$R-H+Na2CO3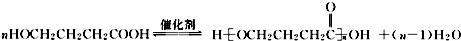 ��
�� ��
��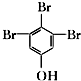 ��д�ṹ��ʽ����
��д�ṹ��ʽ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ݢڢܢۢ� | B�� | �ܢ٢ڢݢ� | C�� | �ڢݢܢ٢� | D�� | �٢ܢڢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ�͡���Ȼ����ȼ�ղ�������������̼ | |
| B�� | ����ȼ�պ������ߵ�ú������������ | |
| C�� | ɭ����ҿ��÷����ƻ�����̬���� | |
| D�� | ���ֻ������ŷŵ�β�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol H2SO4 ������Ϊ98 g•mol-1 | |
| B�� | H2SO4��Ħ������Ϊ98 g | |
| C�� | 9.8 g H2SO4����NA��H2SO4���� | |
| D�� | 6.02��1022��H2SO4���ӵ�����Ϊ9.8 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �����·�У����������缫����ͭ�缫 | |
| B�� | ȡ�����ź����Ƶ�ָ���Է���ƫת | |
| C�� | ���·��ÿͨ��0.1 mol���ӣ�ͭ�����������ϼ�С6.4 g | |
| D�� | ԭ��ص��ܷ�ӦʽΪCu+2AgNO3=2Ag+Cu��NO3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | HA���ʵ���Ũ�ȣ�mol•L-1�� | NaOH���ʵ���Ũ�ȣ�mol•L-1�� | �����Һ��pH |
| �� | 0.2 | 0.2 | pH=a |
| �� | c | 0.2 | pH=7 |
| �� | 0.2 | 0.1 | pH��7 |
| �� | 0.1 | 0.1 | pH=9 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com