
【题目】某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示,下列说法正确的是( )

A. 该装置可以将太阳能转化为电能
B. 阴极的电极反应式为3CO2+4e—=C+2CO32—
C. 高温的目的只是为了将碳酸盐熔融,提供阴阳离子
D. 电解过程中电子由负极流向阴极,经过熔融盐到阳极,最后回到正极
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,使26 g CO和O2的混合气体充分反应,所得混合物在常温下与足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中CO和O2的质量比可能是____________。
(2)某同学在一次实验中发现:将新制氯水逐滴加到含有酚酞的NaOH溶液中,当加到最后一滴时溶液的红色突然消失。
该同学对“溶液的红色突然消失”的原因进行了探究:
①猜测:a.氯水中的盐酸中和了NaOH,使酚酞由红色变为无色;
b._____________。
②请设计一个实验方案验证上述猜测:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属冶炼的反应原理,错误的是( )
A. 高炉炼铁:Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
B. 火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
C. 铝的冶炼:Al2O3+3H2![]() 2Al+3H2O
2Al+3H2O
D. 铝热法炼铁:Fe2O3+2Al![]() 2Fe +Al2O3
2Fe +Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol BaSO4粉末置于盛有500 mL蒸馏水的烧杯中,然后烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
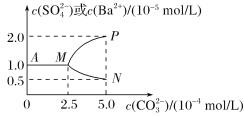
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
D. 若使0.1 mol BaSO4全部转化为BaCO3,至少要加入2.6 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种清洁的化石燃料,也是引起温室效应的一种物质。天然气的综合利用对节能减排、高效利用能源、减少二氧化碳排放有重大意义。作为化工原料,合成甲醇是天然气综合利用的重要途径。
CH4(g)+ CO2(g)![]() 2CO(g)+ 2H2(g)△H=+247.3 kJ·mol—1 ①
2CO(g)+ 2H2(g)△H=+247.3 kJ·mol—1 ①
CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+206.2 kJ·mol—1 ②
CO(g)+3H2(g) △H=+206.2 kJ·mol—1 ②
Ⅰ、合成甲醇的主要反应为:2H2(g)+ CO(g)![]() CH3OH(g) △H=-90.8 kJ·mol—1
CH3OH(g) △H=-90.8 kJ·mol—1
(1)该反应熵变△S________0(填“>、=或<”),该反应在______(填“高温”或“低温”)条件下能自发进行。
(2)生产过程中,合成气要循环,其目的是:________________________________。
(3)T℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下,比较此时正、逆反应速率的大小:υ(正)________υ(逆)(填“>”“<”或“=”)
物质 | H2 | CO | CH3OH |
浓度/(mol·L—1) | 0.20 | 0.10 | 0.40 |
(4)在恒温恒容条件下,充入一定量的H2和CO,发生上述反应,则该反应达到平衡状态的标志有(__________________)
A.混合气体的密度保持不变 B.混合气体的总压强保持不变
C.甲醇的浓度保持不变 D.υ正(H2)= υ逆(CH3OH)
(5)在恒温恒容条件下,要提高反应2H2(g)+ CO(g)![]() CH3OH(g)中CO的转化率,可以采取的措施是(______________)
CH3OH(g)中CO的转化率,可以采取的措施是(______________)
A.升温 B.加入催化剂 C.增加CO的浓度
D.增加H2的浓度 E.充入惰性气体 F.分离出甲醇
Ⅱ、合成甲醇的另一反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0)。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0)。
在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生上述反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

(6)下列措施中能使n(CH3OH )/n(CO2 )增大的是______(填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
(7)经计算该温度下此反应的平衡常数K=0.20 L2·mol—2。若改变条件_________(填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
(8)10min内,用H2表示的该反应的化学反应速率为=_________mol·L—1·min—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或实验操作正确的是

A. ①用pH试纸测某溶液的酸碱性 B. ②探究氧化性:KMnO4>Cl2>I2
C. ③吸收氨气制氨水 D. ④中和滴定实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁——次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含![]() 的工业废水的处理。下列说法正确的是( )
的工业废水的处理。下列说法正确的是( )

A. 图乙中![]() 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
C. 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生
D. 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出Na-CO2电池如下图所示。下列说法错误的是

A. 电池放电时,钠发生氧化反应
B. 正极的电极反应式:2CO2 + 2H2O + 2e- = 2HCO3- + H2↑
C. 理论上消耗23g钠,同时产生22.4L氢气(标准状况)
D. 该装置既可以吸收二氧化碳,又能产生电能、氢燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com