
【题目】将等物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50ml溶液,然后用0.05mol/L盐酸与它反应,得到图象如下(已知:1mol=1000mmol)
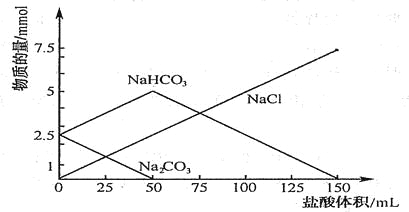
(1)盐酸加到25ml时溶液中发生反应的化学方程式 .
(2)原混合物中Na2CO3物质的量为 mol
(3)盐酸加到150ml时,放出标准状况下气体 mL
【答案】(1) Na2CO3 + HCl =" NaCl" + NaHCO3;(2) 0.05;(3) 112。
【解析】试题分析:(1)由图可知当盐酸加到25mL时,碳酸钠部分反应,反应的化学方程式为:Na2CO3+ HCl= NaCl+NaHCO3;(2)由图可知50ml溶液中碳酸钠完全转化为:碳酸氢钠和氯化钠,消耗盐酸的体积为:50ml,由Na2CO3+HCl=NaCl+NaHCO3可知:n(Na2CO3)=n(HCl)=0.05mol/L×0.05L=0.0025mol,所以1L溶液中碳酸钠的物质的量为n(Na2CO3)=0.0025mol×(1000÷50)=0.05mol;(3)由图50ml~150ml,发生反应为:NaHCO3+HCl=NaCl+H2O+ CO2↑,可知n(CO2)=n(HCl)=100×10-3L×0.05mol/L×22.4L/mol=0.112L=112mL。


科目:高中化学 来源: 题型:
【题目】某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。

(1)关于图像的描述不正确的是______
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式___________________________
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_______
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3;
其中,你认为不合理的方案有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以2mol/L Na2SO4水溶液为电解质的钠离子电池的总反应如下:NaTi2(PO4)3 +Zn+ Na2SO4![]() Na3Ti2(PO4)3 +ZnSO4。其中P的化合价为+5,下列有关说法正确的是( )
Na3Ti2(PO4)3 +ZnSO4。其中P的化合价为+5,下列有关说法正确的是( )
A.放电时,NaTi2(PO4)3发生氧化反应
B.放电时,钠离子向负极移动
C.充电时,阳极反应式为:Zn-2e- =Zn2+
D.充电时,每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修5:有机化学基础】 (15分)
用于治疗精神疾病的药物半富马酸喹硫平的一仲合成路线如下所示:

请回答下列问题:
(1)A中除硫醚键(-S-)外,还含有的官能团是______,反应③是l,3-丁二烯发生l,4-加成反应,则B的系统命名为___________。
(2)反应①~⑤中属于取代反应的有________(选填序号);流程中设计反应⑤和⑦的目的是___________________。
(3)写出反应⑦的化学方程式_____________。
(4)l,3-丁二烯分子中最多有_______个原子共平面,聚l,3-丁二烯的结构简式为__________。
(5)C的同分异构体有多种,符合下列条件的物质的结构简式为_________
① 能发生银镜反应;
② 能与NaoH溶液反应,与NaHCO3溶液不反应;
③ 核磁共振氢谱只有三组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法中正确的是
A.常温常压下,16g CH4中含有的原子总数为5NA
B.78g苯含有碳碳双键的数目为3NA
C.1mol/L NaCl溶液中含有的氯离子数目为NA
D.标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
a | |||||||||||||||||
b | c | d | |||||||||||||||
e | f | g | h | i | |||||||||||||
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2) i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物是溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com