
| A. | X的气态简单氢化物的热稳定性比W的强 | |
| B. | 由Y、Z两种元素组成的化合物是离子化合物 | |
| C. | W的氧化物可与Z的最高氧化物对应水化物反应 | |
| D. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) |
分析 X原子的最外层电子数是其内层电子数的2倍,应为C元素,X、W在同一主族,W应为Si元素,Z+与Y3-具有相同的电子层结构,短周期主族元素X、Y、Z、W的原子序数依次增大,则Y为N元素,Z为Na元素,以此解答该题.
解答 解:由以上分析可知X为C,Y为N,Z为Na,W为Si元素,
A.非金属性C>Si,元素的非金属性越强,对应的氢化物越稳定,故A正确;
B.Y、Z两种元素组成的化合物为Na3N等,是离子化合物,故B正确;
C.W的氧化物为二氧化硅,为酸性氧化物,可与Z的最高氧化物对应水化物氢氧化钠溶液反应,故C正确;
D.Y、Z的离子具有相同的核外电子排布,核电荷数越大离子半径越小,应为r(Y3-)>r(Z+),故D错误.
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生的分析能力,明确物质结构、元素周期律即可解答,熟练掌握同一周期、同一主族元素性质递变规律,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=1 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
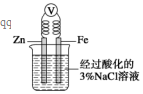
| A. | 将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 | |
| B. | 将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 | |
| C. | 如图,一段时间后给烧杯内的溶液中加入氢氧化钠溶液,可看到Fe电极附近有红褐色沉淀生成 | |
| D. | 向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
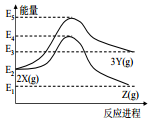
| A. | 由 X→Z 反应的△H<0 | B. | 由 X→Y 反应的△H=E5-E2 | ||
| C. | 增大压强有利于提高 Y 的产率 | D. | 升高温度有利于提高 Z 的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$→_{点燃}^{CO_{2}}$Na2CO3 | |
| B. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | |
| D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g O2含有4NA个电子 | |
| B. | 1L 0.1mol•L-1的氨水中有0.1NA个NH4+ | |
| C. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| D. | 1 mol苯乙烯中含碳碳双键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向[Ag(NH3)2]OH溶液中加入盐酸:Ag++Cl-═AgCl↓ | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
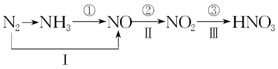 工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com