
| A. | 常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA | |
| B. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 在电解食盐水的实验中,测得阴极析出的气体的分子数为0.5NA,则电解后溶液的pH为14 | |
| D. | 64g的铜发生氧化还原反应,一定失去2NA个电子 |
分析 A、根据NO2和N2O4的最简式均为NO2来分析;
B、根据pH=13,计算出C(H+)和C(OH-),然后根据溶液体积为1.0L来计算;
C、不知道溶液的体积,无法求出溶液的pH;
D、Cu可能生成亚铜离子.
解答 解:A、NO2和N2O4的最简式均为NO2,故46gNO2和N2O4混合气体中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有的原子的物质的量为3mol,个数为3NA,故A正确;
B、溶液的pH=13,故C(H+)=10-13mol/L,可知C(OH-)=0.1mol/L,溶液体积为1.0L,故含有的氢氧根的物质的量为0.1mol,个数为0.1NA,故B错误;
C、不知道溶液的体积,无法求出溶液的pH,故C错误;
D、Cu可能生成亚铜离子,64g的铜发生氧化还原反应,一定失去2NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子种类由质子数和中子数共同决定 | |
| B. | 质子数相同的粒子一定属于同种元素 | |
| C. | 元素的性质主要由元素原子的最外层电子数决定 | |
| D. | 同位素的物理性质有差别而化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )
偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是( )| A. | BaTiO3 | B. | BaTi8O12 | C. | BaTiO4 | D. | BaTi8O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质都能水解,其产物均不相同 | |
| B. | 用高锰酸钾溶液除去混在乙炔中的少量乙烯 | |
| C. | 通过银镜反应可以区分甲醛和乙醛 | |
| D. |  用图所示实验装置制取交纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; (写出名称):苯甲醇
(写出名称):苯甲醇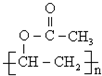 (写出单体的结构简式)CH3COOCH=CH2
(写出单体的结构简式)CH3COOCH=CH2 (写出单体的结构简式)
(写出单体的结构简式) 、HO-CH2-CH2-CH2-CH2-OH.
、HO-CH2-CH2-CH2-CH2-OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 797.5 kJ/mol | B. | 900.5 kJ/mol | C. | 962.5 kJ/mol | D. | 1595 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
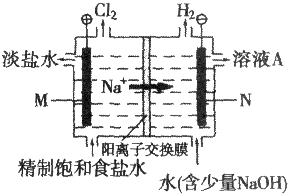
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com