
| A. | 还原性Na>Mg>Al | B. | 氧化性Cl2>S>P | ||
| C. | 酸性H2SO4>H3PO4>HClO4 | D. | 稳定性HCl>H2S>PH3 |
分析 A.金属性越强,其单质的还原性越强;
B.元素的非金属性越强,其单质的氧化性越强;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.金属性越强,其单质的还原性越强,金属性Na>Mg>Al,所以还原性Na>Mg>Al,故A正确;
B.元素的非金属性越强,其单质的氧化性越强,非金属性Cl>S>P,所以氧化性Cl2>S>P,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以其最高价氧化物的水化物酸性HClO4>H2SO4>H3PO4,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以氢化物的稳定性HCl>H2S>PH3,故D正确;
故选C.
点评 本题考查元素周期律,为高频考点,明确金属性、非金属性强弱判断方法是解本题关键,侧重考查学生分析判断及知识综合应用能力,熟练掌握同一周期、同一主族元素周期律,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| B. | 同主族元素的简单阴离子还原性越强,其氢化物越稳定 | |
| C. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| D. | IA族与ⅦA族元素间能形成离子化合物或共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的溶解过程,实质上就是其电离过程 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 1L0.1 mol•L-1的H2SO4溶液中含有0.2 molH+ | |
| D. | 1L0.1 mol•L-1的H2SO3溶液中含有0.2 molH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
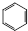 +HNO3$\stackrel{催化剂}{→}$
+HNO3$\stackrel{催化剂}{→}$ +H2O,反应类型取代反应
+H2O,反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、Y、X、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | 若X?Y?W组成的简单离子电子层结构相同,则W离子半径最大. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS.
如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
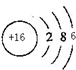
 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.| X | |||
| Z | W | Y |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com