
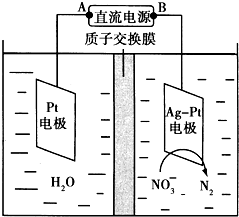
 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
| ||
| 10-2-10-7 |
| 10 |


科目:高中化学 来源: 题型:
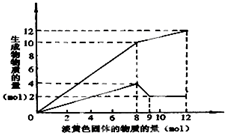 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.7×10-5mol?L-1 |
| HNO2 | 7.1×10-4mol?L-1 |
| HCN | 6.2×10-10mol?L-1 |
| HClO | 4.7×10-8mol?L-1 |
| NH3?H2O | 1.7×10-5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com