
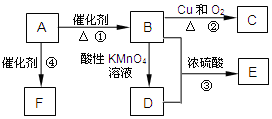
 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.分析 A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,所以A是H2C=CH2,E是具有果香味的有机物,E是酯,酸和醇反应生成酯,则B和D一种是酸一种是醇,B能被氧化生成D,A反应生成B,碳原子个数不变,所以B是CH3CH2OH,D是CH3COOH,铜作催化剂、加热条件下,CH3CH2OH被氧气氧化生成C,所以C是CH3CHO,乙酸与乙醇分子酯化反应生成E为CH3COOCH2CH3,A反应生成F,F是一种高聚物,乙烯发生加聚反应生成高聚物F为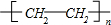 ,据此解答.
,据此解答.
解答 解:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,所以A是H2C=CH2,E是具有果香味的有机物,E是酯,酸和醇反应生成酯,则B和D一种是酸一种是醇,B能被氧化生成D,A反应生成B,碳原子个数不变,所以B是CH3CH2OH,D是CH3COOH,铜作催化剂、加热条件下,CH3CH2OH被氧气氧化生成C,所以C是CH3CHO,乙酸与乙醇分子酯化反应生成E为CH3COOCH2CH3,A反应生成F,F是一种高聚物,乙烯发生加聚反应生成高聚物F为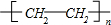 ,
,
(1)通过以上分析知,A为CH2=CH2,故答案为:CH2=CH2;
(2)B发生催化氧化生成C,所以反应类型是氧化反应,故答案为:氧化反应;
(3)该反应为乙醇和乙酸的酯化反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(4)C为乙醛,可以用银镜反应或新制氢氧化铜悬浊液检验乙醛中醛基,其检验方法为取少量C于试管中,加入银氨溶液,水浴加热,产生光亮的银镜(或新制氢氧化铜溶液,产生(砖)红色沉淀),则有醛基,
故答案为:取少量C于试管中,加入银氨溶液,水浴加热,产生光亮的银镜(或新制氢氧化铜溶液,产生(砖)红色沉淀),则有醛基.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确推断物质是解本题关键,易错点是醛基检验方法的语言叙述,检验时要有“实验操作、实验现象、实验结论”,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | CO2和CH4 | C. | NaCl和HCl | D. | CCl4和H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Cu2+、K+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、HCO3-、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Na+、K+、Cl?、SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可以和澄清石灰水反应制造漂白粉 | |
| B. | 金属钠可以用来冶炼某些金属 | |
| C. | 石灰石用于工业炼铁和玻璃制造 | |
| D. | 二氧化硅可以用于制作光学镜片,也可以制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线) | |
| B. | 尿毒症患者使用血液透析治疗 | |
| C. | 明矾净水 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中都分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+Y(?)?aZ(g).此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断不正确的是( )
如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中都分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+Y(?)?aZ(g).此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断不正确的是( )| A. | 物质Z的化学计量数a=1 | |
| B. | 若X、Y均为气态,则在平衡时X的转化率:Ⅰ>Ⅱ | |
| C. | 若Ⅱ中气体的密度变化如图Ⅲ所示,则X、Y中只有一种为气态 | |
| D. | 若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com