
分析 (1)可能发生反应:CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,由方程式可知,完全反应生成碳酸氢钠时,吸收二氧化碳最多,根据n=cV计算NaOH的物质的量,根据方程式计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳体积;
(2)溶液增重4.4g为二氧化碳的质量,其物质的量为0.1mol,故n(CO2):(NaOH)=0.1mol:0.25L×2mol/L=1:5,小于1:2,故氢氧化钠有剩余,蒸发溶液得到的固体为碳酸钠、氢氧化钠,根据碳元素守恒计算碳酸钠的物质的量,根据钠元素守恒计算氢氧化钠的物质的量;
(3)①m1 g白色沉淀为碳酸钙质量,根据碳原子计算n(CO2),再根据V=nVm计算其体积;
②CO2和NaOH反应全部生成NaHCO3时,NaOH的物质的量最小,全部生成Na2CO3时,NaOH的物质的量最大,据此解答;
③取VL NaOH溶液,缓缓向其中通入过量的CO2,充分反应减压低温蒸发溶液,得固体NaHCO3,称其质量为m g,根据n=$\frac{m}{M}$计算NaHCO3的物质的量,根据钠离子守恒计算n(NaOH),进而计算NaOH的物质的量浓度.
解答 解:(1)可能发生反应:CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,由方程式可知,完全反应生成碳酸氢钠时,吸收二氧化碳最多,NaOH的物质的量=0.25L×1mol/L=0.25mol,故吸收二氧化碳的物质的量=0.25mol,二氧化碳的体积=0.25mol×22.4L/mol=5.6L,
故答案为:5.6;
(2)溶液增重4.4g为二氧化碳的质量,其物质的量=$\frac{4.4g}{44g/mol}$=0.1mol,故n(CO2):(NaOH)=0.1mol:0.25L×2mol/L=1:5,小于1:2,故氢氧化钠有剩余,蒸发溶液得到的固体为碳酸钠、氢氧化钠,根据碳元素守恒,碳酸钠的物质的量为0.1mol,
根据钠元素守恒,氢氧化钠的物质的量=0.25L×2mol/L-0.1mol×2=0.3mol,
答:所得固体中碳酸钠为0.1mol、氢氧化钠为0.3mol;
(3)①根据碳原子守恒得n(CO2)=n(CaCO3)=$\frac{{m}_{1}g}{100g/mol}$=$\frac{{m}_{1}}{100}$mol,V(CO2)=$\frac{{m}_{1}}{100}$mol×22.4L/mol=0.224m1 L,
故答案为:0.224m1 L;
②当后应后的生成物只有NaHCO3时,NaOH的物质的量最小,根据钠原子守恒得n(NaOH)=n(NaHCO3)=$\frac{{m}_{1}}{100}$mol,c最小(NaOH)=$\frac{\frac{{m}_{1}}{100}mol}{VL}$=$\frac{0.01{m}_{1}}{V}$mol/L;
当反应后的生成物只有Na2CO3时,NaOH的物质的量最大,根据钠原子守恒得n(NaOH)=2n(Na2CO3)=0.02m1 mol,c最大(NaOH)=$\frac{0.02{m}_{1}mol}{V}$=$\frac{0.02{m}_{1}}{V}$mol/L;
当反应后的生成物是Na2CO3和NaHCO3时,消耗的NaOH在上述的二者之间,故$\frac{0.01{m}_{1}}{V}$mol/L≤c(NaOH)≤$\frac{0.02{m}_{1}}{V}$mol/L,
故答案为:$\frac{0.01{m}_{1}}{V}$mol/L≤c(NaOH)≤$\frac{0.02{m}_{1}}{V}$mol/L;
③方案为:取VLNaOH溶液,缓缓向其中通入过量的CO2,充分反应减压低温蒸发溶液,得固体NaHCO3,称其质量为mg,n(NaOH)=n(NaHCO3)=$\frac{m}{84}$mol,故c(NaOH)=$\frac{\frac{m}{84}mol}{VL}$=$\frac{m}{84V}$ mol/L,
故答案为:取VLNaOH溶液,缓缓向其中通入过量的CO2,充分反应减压低温蒸发溶液,得固体NaHCO3,称其质量为mg;$\frac{m}{84V}$ mol/L.
点评 本题考查化学方程式的计算、实验方案设计,明确发生的化学反应,并学会利用极端假设、原子守恒来解答是解答本题的关键,难度中等.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
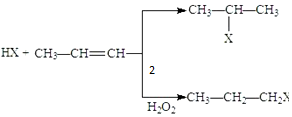 (X为卤素原子)
(X为卤素原子)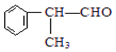 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$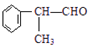
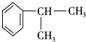 .
.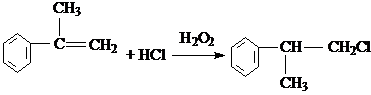 、2
、2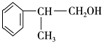 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.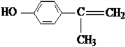 、
、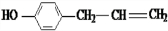 、
、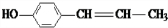 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合物 | SiO2 (Si) | CO2(SO2) | NaHCO3(Na2SiO3) | SiO2(NaCl) |
| 除杂试剂 | 空气 | 饱和碳酸氢钠溶液 | 水、足量二氧化碳 | 水 |
| 除杂方法 | 加热 | 洗气 | 过滤、蒸发 | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO与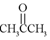 | B. | HOCH2CH3与CH3COOH | ||
| C. | HCOOH与C5H11COOH | D. | C2H4与C3H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com