
家用汽车的调查中发现,新车中气体的质量不符合标准.汽车污染主要来源于汽车配件及材料.它们都会产生大量的有毒有机物气体.其中一种有毒气体的质谱图如下:
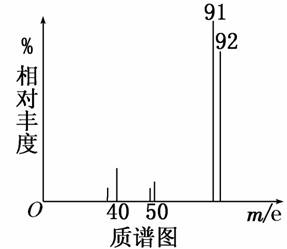
则由图可知该分子的相对分子质量是________,若该分子的核磁共振氢谱中有4个吸收峰则有机物的名称为________,其苯环上的一氯代物有________种。
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的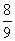 (同温同压下),此时N2、O2、CO2的物质的量之比为 ( )
(同温同压下),此时N2、O2、CO2的物质的量之比为 ( )
A.1∶1∶0 B.6∶9∶0 C.3∶4∶1 D.3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是原子核电荷数不大于18的元素。若X、Y两元素化合物组成是YX3,已知X原子的最外层电子数为a+2,次外层电子数为a+3;Y原子的最外层电子数为b-3,次外层电子数为b。则a和b的值分别是( )
A、3,2 B、2,3 C、5,6 D、5,8
查看答案和解析>>
科目:高中化学 来源: 题型:
在苯的同系物中,加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是( )
A.苯的同系物分子中,碳原子数比苯多
B.苯环受侧链影响,易被氧化
C.侧链受苯环影响,易被氧化
D.由于侧链与苯环的相互影响,使侧链和苯环均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构如图所示,下列选项中均不正确的是( )
①可以燃烧;②能跟Na反应;③分子式为C11H10O2;④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应;⑦含有4种官能团
A.①③④ B.②⑤⑥
C.③⑥⑦ D.④⑥⑦
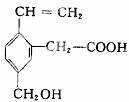
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学
B.蔗糖、淀粉、油脂及其水解产物均为非电解质
C.通过红外光谱分析可以区分乙醇和乙酸
D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
查看答案和解析>>
科目:高中化学 来源: 题型:
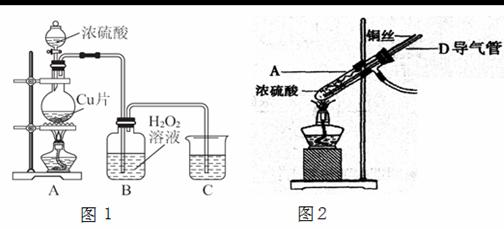 某研究性学习小组设计实验探究铜与浓硫酸的反应。
某研究性学习小组设计实验探究铜与浓硫酸的反应。
(1) 如果用图1装置进行实验:
① 装置A中反应的化学方程式_____________________________________________ 。
② 实验结束后,欲验证反应生成气体的还原性,小组同学取装置B中溶液少量于一洁净的试管中,应向试管中加入的试剂是________(填序号)。
A.品红溶液 B.稀盐酸 C.BaCl2溶液 D.稀硝酸
(2)为了更符合绿色化学的要求,该小组有同学建议用图2装置替换图1装置中的A部分进行探究实验。针对图2装置回答:
①改进后的装置符合绿色化学思想的设计是 。
②准备结束实验时立即熄灭酒精灯,B中的液体不会倒吸,其原因是 。
③拆除装置前,不打开胶塞,要使装置中残留气体完全被吸收,应当采取的操作是
。
(3)实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:a ) 氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
b ) 硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验:
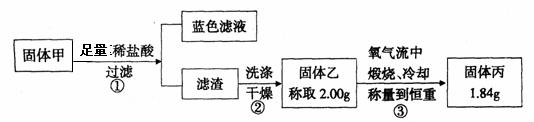
①在煅烧过程中一定发生的反应的化学方程式为 。
②下列对于固体甲成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在 B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S D.固体甲中可能有Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
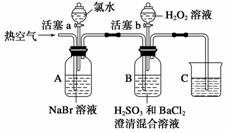
实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,滴加 氯水,关闭活塞a | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是__ _____________________________________________。
_____________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是__________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是__________________
______________________________________________________。
(5)由上述实验得出的结论是________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO3(s) + CO(g)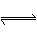 MgO(s) + CO2(g) +SO2(g) △H>0
MgO(s) + CO2(g) +SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com