
(8分)能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为 。


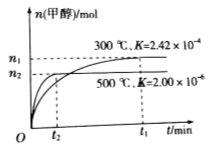
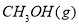 ;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的
;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的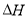 (填“<”“>”或“=”)0。
(填“<”“>”或“=”)0。
(2)利用工业废水中的CO2可制取甲醇,其反应为

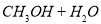 。
。
①已知下列反应的能量变化如图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为 。
②为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示,从反应开始到平衡,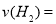 .
.
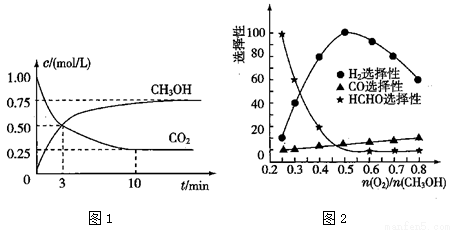
(3)工业上可利用甲醇部分氧化法制取氢气。在一定温度下以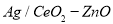 为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制
为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制 = 。
= 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年山东省临沂市高二上10月月考化学试卷(解析版) 题型:选择题
向足量H2SO4溶液中加入100mL 0.4mol·L﹣1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L﹣1盐酸时,放出的热量为2.2 kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣2.92 kJ·mol﹣1
B.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣18 kJ·mol﹣1
C.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣73 kJ·mol﹣1
D.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣0.72 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①②⑤ B.③⑤⑥ C.②④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2016届贵州省兴义市高三上学期期中测试理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是:
A.过量氯气通入溴化亚铁溶液中:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
C.碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++ OH—+HCO3—=CaCO3↓+ H2O
D.用FeCl3溶液腐蚀印刷电路板:Cu+Fe3+=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期第一次月考化学试卷(解析版) 题型:填空题
(每空2分,共10分)实验室里要配制400mL0.2mol/L的硫酸钠溶液。实验步骤大致有:
A.在天平上称出___________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.把得到的溶液小心地沿着玻璃棒注入________mL的容量瓶中。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用_______________小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。
E.将瓶塞塞紧,充分摇匀。
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(1)请填写上述空白处。
(2)下列情况会使所配溶液浓度偏高的是___________(填序号)。
①容量瓶用前内壁沾有水珠 ②没有进行上述的操作步骤C ③未冷却到室温就注入容量瓶定容 ④定容时,水加多了,用滴管吸出 ⑤定容时,仰视容量瓶刻度线 ⑥定容时,俯视容量瓶刻度线
(3)如果实验室用98%的浓硫酸(密度为1.8g·cm-3) 配制 3.6mol·L-1的稀硫酸150mL。计算所需浓硫酸的体积为___________mL。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于强、弱电解质的叙述中,错误的是
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.纯的强电解质在液态时,有的导电,有的不导电
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期第二次月考化学试卷(解析版) 题型:填空题
某消毒液的主要成分为 NaClO(混有少量NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH 溶液吸收Cl2 制备,化学方程式为_______________________。
(2)该消毒液的pH 约为12,离子方程式为__________________________。
(3)向FeSO4 溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为______________。
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。每产生1 mol Cl2(标准状况下),转移电子个数约为________________ 。
查看答案和解析>>
科目:高中化学 来源:2016届河北省邯郸市高三上学期10月月考化学试卷(解析版) 题型:填空题
下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是______,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是_______(用离子符号表示,下同)。②、④、⑤元素的氢化物的沸点由高到低的顺序是____________。
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是________________。
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:
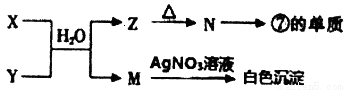
① X、Y与水混合后反应的离子方程式为________________。
② N→⑦的单质反应的化学方程式为_________________。
③ 元素④形成的单质的电子式为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省西安市高一上10月月考化学试卷(解析版) 题型:填空题
(18分)(1)标准状况下,67.2L CO2约是___________ mol,约含有___________个CO2 分子,其中约含有___________ mol氧原子。
(2)要得到含溶质0.2mol的溶液,需取0.05mol/L的氢氧化钡溶液___________mL。
(3)9.2g氮的氧化物NOx中含有N原子数为0.2mol,则NOx的摩尔质量为__________,x的数值为___________,这些质量的NOx在标准状况下的体积约为_____________L。
(4)常温下,相对分子质量为M的某无水盐A的溶解度为Sg,则常温时,该盐饱和溶液质量分数为__________,如果已知该饱和溶液的密度为ρg/cm3,则该溶液的物质的量浓度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com