
”¾ĢāÄæ”æ(1)Ē°ĖÄÖÜĘŚÖŠµÄŅ»²æ·ÖČēĶ¼£¬ČōBŌŖĖŲŌ×ÓŠņŹżĪŖx£¬ŌņA”¢C”¢D”¢EŌ×ÓŠņŹżÖ®ŗĶĪŖ£Ø________________£©
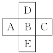
(2)ŗĖÄŚÖŠ×ÓŹżĪŖNµÄR2£«£¬ÖŹĮæŹżĪŖA£¬ŌņĖüµÄn gŃõ»ÆĪļÖŠĖłŗ¬ÖŹ×ÓµÄĪļÖŹµÄĮæŹĒ£Ø______£©mol
(3)×īĶā²ćµē×ÓŹżĪŖ2µÄŌŖĖŲÓŠ _______ (ĢīŌŖĖŲ·ūŗÅ£¬ĻĀĶ¬)”£
×īĶā²ćµē×ÓŹżÓė“ĪĶā²ćµē×ÓŹżĻąµČµÄŌŖĖŲÓŠ________
(4)ŌŚ”°ŹÆĄÆ”śŅŗĢåŹÆĄÆ”śŹÆĄÆÕōĘų”śĮŃ»ÆĘų”±µÄ±ä»Æ¹ż³ĢÖŠ£¬±»ĘĘ»µµÄ×÷ÓĆĮ¦ŅĄ“ĪŹĒ____ ”¢ ____ ”¢ ____________________
”¾“š°ø”æ4X+10 n(A£N£«8) /(A+16) He Be Mg Be Ar ·Ö×Ó¼ä×÷ÓĆĮ¦ ·Ö×Ó¼ä×÷ÓĆĮ¦ ¹²¼Ū¼ü
”¾½āĪö”æ
(1)ÓÉĶ¼£¬ČōBŌŖĖŲŌ×ÓŠņŹżĪŖx£¬ÓÉĻą¶ŌĪ»ÖĆæÉÖŖA”¢C”¢D”¢EŌ×ÓŠņŹż£»
(2)ŗĖÄŚÖŠ×ÓŹżĪŖNµÄR2£«£¬ÖŹĮæŹżĪŖA£¬·Ö±šĒó³öŃõ»ÆĪļÖŹĮæŹż”¢ÖŹ×ÓŹż”¢ĪļÖŹµÄĮ棬¼“æÉĒóŃõ»ÆĪļÖŠĖłŗ¬ÖŹ×ÓµÄĪļÖŹµÄĮ棻
(3)ÓÉŌ×ӵĵē×ÓÅŲ¼æÉÖŖ£»
(4)ŹÆĄÆµÄČżÖÖדĢ¬×Ŗ»ÆĘĘ»µµÄŹĒ·Ö×Ó¼ä×÷ÓĆĮ¦£¬»Æѧ·“Ó¦ĘĘ»µµÄŹĒ¹²¼Ū¼ü”£
(1)Ē°ĖÄÖÜĘŚÖŠµÄŅ»²æ·ÖČēĶ¼£¬ČōBŌŖĖŲŌ×ÓŠņŹżĪŖx£¬ŌņAĪŖx-1”¢CĪŖx+1”¢DĪŖx-8”¢EĪŖx+18”£A”¢C”¢D”¢EŌ×ÓŠņŹżÖ®ŗĶĪŖ4X+10£»
(2)ŗĖÄŚÖŠ×ÓŹżĪŖNµÄR2£«£¬ÖŹĮæŹżĪŖA£¬ĖüµÄŃõ»ÆĪļROµÄÖŹĮæŹżĪŖ£ØA+16£©£¬ÖŹ×ÓŹżĪŖ£ØA-N+8£©£¬Ōņn gŃõ»ÆĪļÖŠĖłŗ¬ÖŹ×ÓµÄĪļÖŹµÄĮæŹĒn(A£N£«8) /(A+16) mol£»
(3) ×īĶā²ćµē×ÓŹżĪŖ2µÄŌŖĖŲÓŠHe”¢Be”¢Mg”£×īĶā²ćµē×ÓŹżÓė“ĪĶā²ćµē×ÓŹżĻąµČµÄŌŖĖŲÓŠBe”¢Ar£»
(4)ŌŚ”°ŹÆĄÆ”śŅŗĢåŹÆĄÆ”śŹÆĄÆÕōĘų”śĮŃ»ÆĘų”±µÄ±ä»Æ¹ż³ĢÖŠ£¬±»ĘĘ»µµÄ×÷ÓĆĮ¦ŅĄ“ĪŹĒ·Ö×Ó¼ä×÷ÓĆĮ¦”¢·Ö×Ó¼ä×÷ÓĆĮ¦”¢¹²¼Ū¼ü£»



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ£»ÆѧŹµŃ銔×éŌŚ”°Ģ½¾æµāĖ®ÓėFeCl2ČÜŅŗÄÜ·ń·“Ó¦”±µÄĻµĮŠŹµŃéÖŠ·¢ĻÖ£ŗŌŚ×ćĮæµÄĻ”KIČÜŅŗÖŠ£¬¼ÓČė1~2µĪFeCl3ČÜŅŗ£¬Õńµ“ŗóČÜŅŗ³Ź»ĘÉ«”£
£Ø²éŌÄ׏ĮĻ£©
µāĪ¢ČÜÓŚĖ®£¬µāµÄĖ®ČÜŅŗŃÕÉ«ĖęÅØ¶Č±ä»Æ³ŹĻÖ»ĘÉ«»ņ×ŲÉ«£¬µāĖ®ÖŠŗ¬ÓŠµāµ„ÖŹ£»ŗ¬Fe3+µÄČÜŅŗŅ²³Ź»ĘÉ«”£
£ØĢį³öĪŹĢā£©
Fe3+”¢I2µÄŃõ»ÆŠŌĒæČõĒéæö”£
£ØĢį³ö²ĀĻė£©
£Ø1£©¼×Ķ¬Ń§ČĻĪŖŃõ»ÆŠŌI2£¾Fe3+£¬¹ŹÉĻŹöŹµŃéĻÖĻó²»ŹĒ·¢Éś»Æѧ·“Ó¦ĖłÖĀ£¬ŌņČÜŅŗ³Ź»ĘÉ«ŹĒŅņĪŖŗ¬______£»ŅŅĶ¬Ń§ČĻĪŖŃõ»ÆŠŌFe3+£¾I2£¬¹ŹÉĻŹöŹµŃéĻÖĻóŹĒ·¢Éś»Æѧ·“Ó¦ĖłÖĀ£¬ŌņČÜŅŗ³Ź»ĘÉ«ŹĒŅņĪŖŗ¬_______”£
£ØÉč¼ĘŹµŃé²¢ŃéÖ¤£©
£Ø2£©ĪŖŃéÖ¤ŅŅĶ¬Ń§µÄ¹ŪµćÕżČ·£¬±ūĶ¬Ń§Ń”ÓĆĻĀĆęĖłĢį¹©µÄŹŌ¼ĮÉč¼Ę³öŅŌĻĀĮ½ÖÖ·½°ø½ųŠŠŹµŃ飬ĒėĶź³ÉĻĀĮŠ±ķøń”£¹©Ń”ÓƵďŌ¼Į£ŗa£®·ÓĢŖŹŌŅŗ b£®ĖÄĀČ»ÆĢ¼ c£®ĪŽĖ®¾Ę¾« d£®KSCNČÜŅŗ
ĒėÄćŌŚĻĀĮŠ±ķøńÖŠŠ“³ö±ūĶ¬Ń§Ń”ÓƵďŌ¼Į¼°ŹµŃéÖŠ¹Ū²ģµ½µÄĻÖĻó”££ØŹŌ¼ĮĢīŠņŗÅ£©
ŹŌ¼Į | ŹµŃéĻÖĻó | |
·½°ø1 | ____________ | ______ |
·½°ø2 | ______ | _________ |
£ØŹµŃé½įĀŪ£©
Ńõ»ÆŠŌ£ŗFe3+£¾I2”£
£ØĶŲÕ¹Ó¦ÓĆ£©
£Ø3£©¢Łøł¾ŻÉĻŹöŹµŃéĶĘ²ā£¬ČōŌŚFeI2ČÜŅŗÖŠĶØČėĀČĘų£¬Ź×Ļȱ»Ńõ»ÆµÄĄė×ÓŹĒ________”£
¢ŚŌŚ100mL FeI2ČÜŅŗÖŠĶØČė2.24LCl2£Ø±ź×¼×“æöĻĀ£©£¬ČÜŅŗÖŠČōÓŠ![]() µÄFe2+ ±»Ńõ»Æ£¬ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾øĆ·“Ó¦¹ż³Ģ£ŗ___”£
µÄFe2+ ±»Ńõ»Æ£¬ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾øĆ·“Ó¦¹ż³Ģ£ŗ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»ÖÖæɳäµēļ®-æÕĘųµē³ŲČēĶ¼ĖłŹ¾”£µ±µē³Ų·ÅµēŹ±£¬O2ÓėLi+ŌŚ¶ąæ×Ģ¼²ÄĮĻµē¼«“¦Éś³ÉLi2O2-x£Øx=0»ņ1£©”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ·ÅµēŹ±£¬¶ąæ×Ģ¼²ÄĮĻµē¼«ĪŖøŗ¼«
B. ·ÅµēŹ±£¬ĶāµēĀ·µē×ÓÓɶąæ×Ģ¼²ÄĮĻµē¼«Į÷Ļņļ®µē¼«
C. ³äµēŹ±£¬µē½āÖŹČÜŅŗÖŠLi+Ļņ¶ąæ×Ģ¼²ÄĮĻĒųĒØŅĘ
D. ³äµēŹ±£¬µē³Ų×Ü·“Ó¦ĪŖLi2O2-x=2Li+£Ø1£![]() £©O2
£©O2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĀČ»ÆĆ¾ČÜŅŗµÄĆܶČĪŖ1.18 g”¤cm£3£¬ĘäÖŠĆ¾Ąė×ÓµÄÖŹĮæ·ÖŹżĪŖ5.1%”£300 mLøĆČÜŅŗÖŠĀČĄė×ÓµÄĪļÖŹµÄĮæŌ¼µČÓŚ(””””)
A. 0.37 mol B. 0.63 mol C. 0.74 mol D. 1.5 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņõ£ĀČ£ØSO2Cl2£©ŹĒÖŲŅŖµÄ»ÆѧŹŌ¼Į£¬æÉÓÉČēĻĀ·“Ó¦ÖĘČ”£ŗSO2£Øg£©+Cl2£Øg£©![]() SO2Cl2£Øg£©”÷HÕė¶ŌøĆ·“Ó¦»Ų“šĻĀĮŠĪŹĢā£ŗ
SO2Cl2£Øg£©”÷HÕė¶ŌøĆ·“Ó¦»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŅŃÖŖ£ŗ¢ŁSO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©![]() 2SOCl2£Øg£©”÷H1=©akJmol©1
2SOCl2£Øg£©”÷H1=©akJmol©1
¢ŚSO2Cl2+SCl2£Øg£©=2SOCl2£Øg£©”÷H2=©bkJmol©1
¢Ūa£¾b£¾0Ōņ”÷H=______kJmol©1£ØÓĆŗ¬a”¢bµÄ“śŹżŹ½±ķŹ¾£©
£Ø2£©ĪŖĮĖĢįøßøĆ·“Ó¦ÖŠCl2µÄĘ½ŗā×Ŗ»ÆĀŹ£¬ĻĀĮŠ“ėŹ©ŗĻĄķµÄŹĒ______£ØĢī×ÖÄøŠņŗÅ£©£®
a£®ĖõŠ”ČŻĘ÷Ģå»ż””b£®Ź¹ÓĆ“ß»Æ¼Į””c£®Ōö¼ÓSO2ÅØ¶Č””d£®ÉżøßĪĀ¶Č
£Ø3£©ČōŌŚ¾ųČČ”¢ŗćČŻµÄĆܱÕĢåĻµÖŠ£¬Ķ¶ČėŅ»¶ØĮæSO2ŗĶCl2£¬·¢ÉśøĆ·“Ó¦£¬ĻĀĮŠŹ¾ŅāĶ¼ÄÜĖµĆ÷t1Ź±æĢ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ______£ØĢī×ÖÄøŠņŗÅ£©£®£ØĻĀĶ¼ÖŠ¦ŌÕż”¢K”¢n”¢m·Ö±š±ķŹ¾Õż·“Ó¦ĖŁĀŹ”¢Ę½ŗā³£Źż”¢ĪļÖŹµÄĮæŗĶÖŹĮ棩

£Ø4£©ČōŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬½«nmolSO2ÓėnmolCl2³äČėČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬²¢Ź¼ÖÕ±£³ÖĪĀ¶ČĪŖT£¬Ń¹ĒæĪŖP£®ĘšŹ¼Ź±ĘųĢå×ÜĢå»żĪŖ10L£¬t minŹ±·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬“ĖŹ±ĘųĢå×ÜĢå»żĪŖ8L£®
¢ŁŌŚČŻ»żøıäµÄĢõ¼žĻĀ£¬·“Ó¦ĖŁĀŹæÉÓƵ„Ī»Ź±¼äÄŚ·“Ó¦Īļ»ņÉś³ÉĪļµÄĪļÖŹµÄĮæ±ä»ÆĄ“±ķŹ¾£®Ōņ¦Ō£ØSO2£©=____£®
¢Ś“ĖĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄK=___£®
¢ŪĻąĶ¬Ģõ¼žĻĀ£¬Čō½«0.5nmolSO2Óė0.5nmolCl2³äČėøĆČŻĘ÷£¬µ½“ļĘ½ŗāדĢ¬Ź±£¬»ģŗĻĪļÖŠSO2Cl2µÄĪļÖŹµÄĮæŹĒ____£®
£Ø5£©øĆ·“Ó¦µÄ²śĪļSO2Cl2ÓöĖ®·¢Éś¾ēĮŅĖ®½āÉś³ÉĮ½ÖÖĒæĖį£¬Š“³öĘä»Æѧ·½³ĢŹ½____£»ŅŃÖŖ25”ꏱ£¬Ksp[AgCl]=1.8”Į10©10£¬Ksp[Ag2SO4]=1.4”Į10©5£¬ŌņSO2Cl2ÓŚĖ®ĖłµĆČÜŅŗÖŠÖšµĪ¼ÓČėAgNO3Ļ”ČÜŅŗŹ±£¬×īĻČ²śÉśµÄ³ĮµķŹĒ______£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»Æѧ·½³ĢŹ½ÖŠ£¬²»ÄÜÕżČ·±ķ“ļ·“Ó¦ŃÕÉ«±ä»ÆµÄŹĒ
A. ĻņCuSO4ČÜŅŗÖŠ¼ÓČė×ćĮæZn·Ū£¬ČÜŅŗĄ¶É«ĻūŹ§Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. ³ĪĒåµÄŹÆ»ŅĖ®¾ĆÖĆŗó³öĻÖ°×É«¹ĢĢåCa(OH)2+CO2![]() CaCO3”ż+H2O
CaCO3”ż+H2O
C. Na2O2ŌŚæÕĘųÖŠ·ÅÖĆŗóÓɵ»ĘÉ«±äĪŖ°×É«2Na2O2![]() 2Na2O+O2”ü
2Na2O+O2ӟ
D. ĻņMg(OH)2Šü×ĒŅŗÖŠµĪ¼Ó×ćĮæFeCl3ČÜŅŗ³öĻÖŗģŗÖÉ«³Įµķ3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ×ī½üĪŅ¹śæĘѧ¼ŅÉč¼ĘĮĖŅ»ÖÖCO2+H2SŠĶ¬×Ŗ»Æ×°ÖĆ£¬ŹµĻÖ¶ŌĢģČ»ĘųÖŠCO2ŗĶH2SµÄøߊ§Č„³ż”£Ź¾ŅāĶ¼ČēĶ¼ĖłŹ¾£¬ĘäÖŠµē¼«·Ö±šĪŖZnO@ŹÆÄ«Ļ©£ØŹÆÄ«Ļ©°ü¹üµÄZnO£©ŗĶŹÆÄ«Ļ©£¬ŹÆÄ«Ļ©µē¼«Ēų·¢Éś·“Ó¦ĪŖ£ŗ

¢ŁEDTA-Fe2+-e-£½EDTA-Fe3+
¢Ś2EDTA-Fe3++H2S£½2H++S+2EDTA-Fe2+
øĆ×°ÖĆ¹¤×÷Ź±£¬ĻĀĮŠŠšŹö“ķĪóµÄŹĒ
A. Ņõ¼«µÄµē¼«·“Ó¦£ŗCO2+2H++2e-£½CO+H2O
B. ŠĶ¬×Ŗ»Æ×Ü·“Ó¦£ŗCO2+H2S£½CO+H2O+S
C. ŹÆÄ«Ļ©ÉĻµÄµēŹĘ±ČZnO@ŹÆÄ«Ļ©ÉĻµÄµĶ
D. Čō²ÉÓĆFe3+/Fe2+Č”“śEDTA-Fe3+/EDTA-Fe2+£¬ČÜŅŗŠčĪŖĖįŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĆܱÕČŻÖŠ·¢ÉśĻĀĮŠ·“Ó¦aA(g)![]() cC(g)£«dD(g)£¬·“Ó¦“ļµ½Ę½ŗāŗ󣬽«ĘųĢåĢå»żŃ¹Ėõµ½ŌĄ“µÄŅ»°ė,ŌŁ“Ī“ļµ½Ę½ŗāŹ±£¬DµÄÅضČĪŖŌĘ½ŗāµÄ1.8±¶£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
cC(g)£«dD(g)£¬·“Ó¦“ļµ½Ę½ŗāŗ󣬽«ĘųĢåĢå»żŃ¹Ėõµ½ŌĄ“µÄŅ»°ė,ŌŁ“Ī“ļµ½Ę½ŗāŹ±£¬DµÄÅضČĪŖŌĘ½ŗāµÄ1.8±¶£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
A. AµÄ×Ŗ»ÆĀŹ±ä“ó B. Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆ
C. DµÄĢå»ż·ÖŹż±ä“ó D. a £¼ c£«d
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÖŠ¹śæĘѧ¼¼ŹõĆū“ŹÉó¶ØĪÆŌ±»įŅŃČ·¶ØµŚ116ŗÅŌŖĖŲLvµÄĆū³ĘĪŖćW”£¹ŲÓŚ![]() µÄŠšŹö“ķĪóµÄŹĒ( )
µÄŠšŹö“ķĪóµÄŹĒ( )
A. Ō×ÓŠņŹż116B. ÖŠ×ÓŹż177
C. ŗĖĶāµē×ÓŹż116D. Ļą¶ŌŌ×ÓÖŹĮæ293
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com