
分析 (1)c(H+)=c(HA)×电离度;酸溶液中水电离出的c(H+)等于溶液中c(OH-);
(2)溶解平衡常数等于离子浓度系数次幂之积;
(3)pH=3的盐酸和pH=3的HA溶液各稀释至其体积的100倍,盐酸增加两个单位,而HA是弱电解质加水稀释促进HA的电离,所以PH增加不到两个单位;
(4)常温下,NaA为强碱弱酸盐,弱酸根离子水解导致溶液呈碱性;
(5)盛装标准HA的仪器名称为酸式滴定管,滴定终点碱性变中性,所以酚酞溶液由红色变成无色,且半分钟内不褪色;根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差.
解答 解:(1)c(H+)=c(HA)×电离度=0.1mol/L×0.1%=10-4 mol/L;酸溶液中水电离出的c(H+)等于溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,
故答案为:10-4 mol/L;10-10 mol/L;
(2)溶解平衡常数等于离子浓度系数次幂之积,则溶解平衡时的Ksp(MgA2)=c(Mg2+)c2(A-);
故答案为:c(Mg2+)c2(A-);
(3)pH=3的盐酸和pH=3的HA溶液各稀释至其体积的100倍,盐酸增加两个单位,而HA是弱电解质加水稀释促进HA的电离,所以PH增加不到两个单位,所以稀释后盐酸的pH 大于HA溶液的pH,
故答案为:大于;
(4)常温下,NaA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,水解方程式为A-+H2O?HA+OH-,
故答案为:碱;A-+H2O?HA+OH-;
(5)盛装标准HA的仪器名称为酸式滴定管,滴定终点碱性变中性,所以酚酞溶液由红色变成无色,且半分钟内不褪色,
A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;
D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;
故答案为:酸式滴定管;溶液由红色变成无色,且半分钟内不褪色;AC.
点评 本题考查了溶液中离子浓度加水、酸碱中和滴定操作、误差分析以及注意事项,溶解平衡的应用,题目难度中等,应注意相关知识的积累,侧重于考查学生的分析能力和计算能力.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
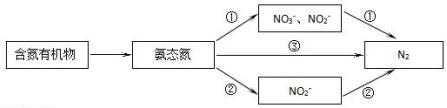
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可用新制的氢氧化铜悬浊液检验 | |
| B. | 实验室由Y和M制取乙酸乙酯时可用饱和Na2CO3溶液来提纯 | |
| C. | 乙酸乙酯的同分异构体中含有“-COO-”结构的还有3种 | |
| D. | Y分子中含有3种不同环境的氢,峰面积比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
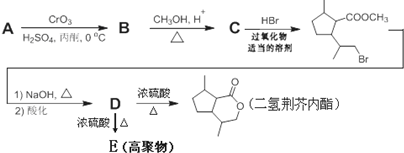
 ,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.
,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.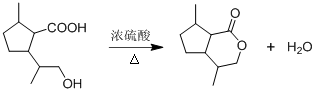 .
. .
. ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.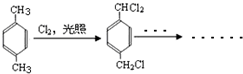
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子离核越近,能量越高 | |
| B. | 原子核外电子的运动没有规律 | |
| C. | 在多电子原子中,核外电子分层排布 | |
| D. | 电子一般尽可能排布在能量高的电子层中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com