
【题目】实验室常用浓盐酸的质量分数为36.5%,密度为1.20 g/cm3。现用该浓盐酸配制100 mL 3.00 mol/L的盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀盐酸时,上述仪器中不需要使用的有_________(选填序号),还缺少的仪器有_________(仪器名称)。
(2)经计算,配制100 mL 3.00 mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为_________mL(保留一位小数),量取浓盐酸时应选用_________(选填①10 mL、②50 mL、③100 mL的序号)规格的量筒。
(3)用配制所得100mL该稀盐酸与过量的铁屑充分反应,可制得氢气_________L(标准状况)。将生成的FeCl2配制成500 mL溶液,所得溶液中FeC12的物质的量浓度为_________mol/L。
【答案】 ②④⑥ 100 mL,容量瓶、玻璃棒 25. 0 ② 3. 36 0.3
【解析】(1) 配制步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、烧杯、100ml容量瓶,用不到②烧瓶;④药匙;⑥托盘天平,还缺少的仪器是100ml容量瓶、玻璃棒,故答案为:②④⑥; 100 mL容量瓶、玻璃棒;
(2) 浓盐酸的物质的量浓度c=![]() =
=![]() =12mol/L,溶液稀释前后溶质的物质的量不变,则有0.10L×3.00mol/L=12.0mol/LV(浓),V(浓)=0.0250L,即25.0ml,应该选用50 mL的量筒量取浓盐酸,故答案为:25.0;②;
=12mol/L,溶液稀释前后溶质的物质的量不变,则有0.10L×3.00mol/L=12.0mol/LV(浓),V(浓)=0.0250L,即25.0ml,应该选用50 mL的量筒量取浓盐酸,故答案为:25.0;②;
(3) 100mL该稀盐酸中含有氯化氢的物质的量为0.10L×3.00mol/L=0.3mol,与过量的铁屑充分反应,可制得氢气0.15mol,标准状况下的体积为0.15mol×22.4L/mol=3.36L;同时生成0.15mol FeCl2,配制成500 mL溶液,所得溶液中FeC12的物质的量浓度为![]() =0.3mol/L,故答案为:3.36;0.3。
=0.3mol/L,故答案为:3.36;0.3。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】分子式为C8H16O2的有机物A,能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A可能的结构有 ( )
A.1种 B.2种
C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别CH4、C2H4、C2H2三种气体可采用的方法是( )
A. 通入溴水中,观察溴水是否褪色 B. 通入酸化的KMnO4溶液中,观察颜色变化
C. 点燃,检验燃烧产物 D. 点燃,观察火焰明亮程度及产生黑烟的量多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是
A. 电解饱和氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B. Fe(OH)3溶于氢碘酸:Fe(OH)3+ 3H+=Fe3++3H2O
C. NaAlO2溶液中 AlO2-的水解:AlO2-+2H2O=Al(OH)3+ OH-
D. 向KAl(SO4)2溶液中加过量的Ba(OH)2溶液:Al3++2SO42- +2Ba2++4 OH-= AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨及铵盐都是重要的化工原料。
I.某兴趣小组制取氨气并探究氨的催化氧化实验。
(1)实验室制取氨气的化学反应方程式为_________________。
(2)如图,分别从A、B两管口通入干燥的氨气和氧气,为保证在装置3中观察到红棕色气体,装置2应装入________;若取消装置2,在装置3中仅观察到大量白烟,原因是______________。
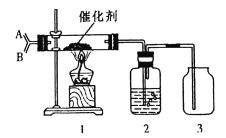
(3)氨气常用于检验化工生产中氯气是否泄漏,因为氯气有少量泄漏时用氨气检验会有白烟生成,同时生成一种对大气无污染的产物,试写出该反应的化学方程式:_________________。
Ⅱ.(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)
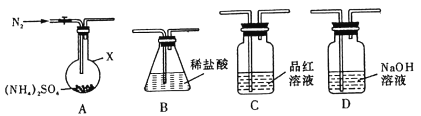
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5 mol/L盐酸70 mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,用0.2 mol/L NaOH溶液中和剩余盐酸,消耗NaOH溶液25 mL。经检验中和后的溶液中无SO42-。
(4)装置B内溶液吸收气体的物质的量是_________mol。
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-、无SO42-,进一步研究发现,气体产物中无氮氧化物。
(5)检验装置D内溶液中有SO32-、无SO42-的实验操作和现象是:___________________。
(6) (NH4)2SO4在400℃分解的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2 和 ZnC2、Al4C3、Mg2C3、Li2C2 等都同属离子型碳化物。请通过对 CaC2 制 C2H2 的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A. ZnC2 水解生成乙烷(C2H6)
B. Al4C3 水解生成丙炔(C3H4)
C. Mg2C3 水解生成丙炔(C3H4)
D. Li2C2 水解生成乙烯(C2H4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,四种一元弱酸的电离常数为:Ka(HCN)=6.2×10-10 mol/L、Ka(HF)=6.8×10-4 mol/L、Ka(CH3COOH)=1.8×10-5 mol/L、Ka(HNO2)=6.4×10-6 mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是:
A. HCN B.CH3COOH C.HF D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盐类的水解过程中,下列各种情况必定发生的是( )
A.盐的电离平衡被破坏 B.溶液温度升高
C.25℃,溶液的pH不是7 D.水的电离平衡被破坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com