
元素的原子半径在周期表中呈现周期性变化的根本原因是( )
A.原子的相对原子质量呈现周期性变化
B.元素的化合价呈现周期性变化
C.原子的性质呈现周期性变化
D.元素原子的核外电子排布呈周期性变化
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
下列各组离子在给定条件下能大量共存的是( )
A.在pH=1的溶液中:NH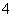 、K+、ClO-、Cl-
、K+、ClO-、Cl-
B.有SO 存在的溶液中:Na+、Mg2+、Ba2+、I-
存在的溶液中:Na+、Mg2+、Ba2+、I-
C.有NO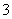 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH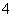 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、K+、AlO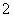 、SO
、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
核糖体是细胞内一种核糖核蛋白颗粒,主要由rRNA和蛋白质构成,其唯一功能是按照mRNA的指令将氨基酸合成蛋白质多肽链,所以核糖体是细胞内蛋白质合成的分子机器。下列说法不正确的是 ( )。
A.糖类和蛋白质都是人体重要的营养物质
B.蛋白质在一定条件下能发生水解反应,生成氨基酸
C.加热能杀死甲型H1N1流感病毒,因为病毒的蛋白质受热变性
D.蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaCl的摩尔质量为58.5 g·mol-1,其晶体密度为d g·cm-3,若图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示为 ( )。
A.117a3d B.58.5/(2a3d)
C.234/(a3d) D.58.5/(4a3d)
查看答案和解析>>
科目:高中化学 来源: 题型:
第114号元素是化学家和物理学家很感兴趣的尚未发现的元素,推测此元素在周期表中的位置为( )
A.第8周期ⅢA族 B.第6周期ⅤA族
C.第7周期ⅣB族 D.第7周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
基态Fe原子有________个未成对电子。Fe3+的电子排布式为________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1.依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com