
X、Y、Z、W、R属于短周期主族元素。X的原子半径短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是( )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。
【知识点】元素周期表和元素周期律
【答案解析】D 解析:X的原子半径在短周期主旋元素中最大,为Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,所以Y为O元素,Z为Si元素,W元素与Z元素同主族,为C元素,R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,则R的核外电子数为16,为S元素。
A、X与Y形成的两种化合物分别为Na2O、Na2O2,两种化合物中阴、阳离子的个数比均为1:2,故A正确;B、Y是O元素,R是S元素,元素的非金属性越强其氢化物越稳定,氧元素的非金属性大于硫元素,所以水的稳定性大于硫化氢,且水中含有氢键,沸点高,故B正确;C、非金属性:S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D、SO2、CO2对应的酸的酸性比盐酸弱,与氯化钡都不反应,故D错误。
故答案选D
【思路点拨】本题考查原子结构和元素周期律的递变规律,题目难度中等,根据原子结构特


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
百合具有润肺止咳、养颜美容等功效,百合中含有秋水仙碱,其化学式为C22H25NO6,下列说法中正确的是( )
A.秋水仙碱由碳、氢、氧三种元素组成
B.一个秋水仙碱分子由22个碳原子、25个氢原子、1个氮原子和3个氧分子构成
C.秋水仙碱分子中碳、氢、氮、氧原子个数比为22:25:1:6
D.秋水仙碱中氢元素的质量分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
帕拉米韦氯化钠注射液是治疗H7N9亚型禽流感的有效药物之一,帕拉米韦的化学式为C15H28NxO4。试计算:
(1)帕拉米韦的相对分子质量为328,则x的数值为 ;
(2)32.8g的帕拉米韦中氧元素的质量为 g(结果精确到0.1g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为某钙片的商品标签,请根据标签的有关信息完成下列各题:
(1)主要成分碳酸钙(CaCO3)由________种元素组成。
(2)碳酸钙中钙、碳、氧元素的质量比为______________。
(3)某儿童按标签用量服药,每天补充钙元素质量是________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ:硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO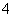 +8H+===5Fe3++Mn2++4H2O
+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.稀硫酸 B.浓硝酸 C.稀硝酸 D.稀盐酸
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)。
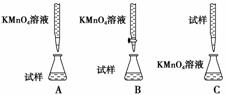
方案二 重量法 操作流程如下:
(4) 步骤②是否可以省略,其理由是______________________________________________。
(5)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
II:硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
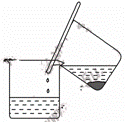
图1
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
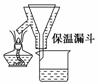
图2
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图1分离方法称为________法。
(2)步骤2中有一处明显不合理的是______________________________________________
趁热过滤的理由是________________________________________________。
(3)步骤3加热浓缩过程中,当______________________________________时停止加热。用无水乙醇洗涤晶体的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需配制一种仅含五种离子(不考虑水解和水电离出的离子)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为5 mol/L,下面四个选项中能达到此目的的是( )
A.Na+、K+、SO42−、NO3−、Cl− B.Fe2+、H+、Br−、NO3−、Cl−
C.Ca2+、K+、OH−、Cl−、NO3− D.Al3+、Na+、Cl−、SO42−、NO3−
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,发生CO + NO2 
 CO2 + NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是
CO2 + NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是
A、正反应为吸热反应 B、正反应为放热反应
C、降温后CO的浓度增大 D、降温后各物质的浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com