
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法有错误的是()
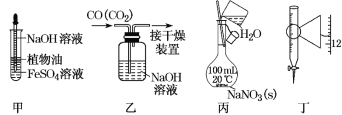
A.用装置甲观察Fe(OH)2的生成
B.用装置乙除去CO中的CO2
C.用装置丙配制一定物质的量浓度的NaNO3溶液
D.装置丁为25mL滴定管,读数为11.80mL
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.澄清石灰水中加入过量小苏打溶液:![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O ===2C6H5OH↓+![]()
C.潮湿环境中钢铁发生电化学腐蚀的反应:Fe+2H2O=Fe(OH)2+H2↑
D.酸性溶液中KIO3与KI反应生成I2:![]() +5I-+6H+=3I2+3H2O
+5I-+6H+=3I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是( )
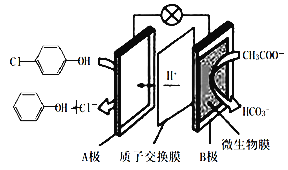
A.本装置集净化、供电于一体,产物之一还有消毒作用
B.每消耗1mol CH3COO-,通过质子交换膜的质子的物质的量为8mol
C.在该装置中,B极上的电势比A极上的电势高
D.A极的电极反应为![]() +H++2e-→
+H++2e-→![]() +Cl-
+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
⑴铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_______。
⑵已知反应:

①乙酸酐分子中碳原子轨道的杂化类型为______。
②1 mol对甲基苯乙酮分子中含有的σ键的数目为_____。
③甲苯分子难溶于水的原因是______。
④单个AlCl3气态分子的空间构型为______,AlCl3可与Cl-形成AlCl![]() ,与AlCl
,与AlCl![]() 互为等电子体的分子为______。
互为等电子体的分子为______。
(3)某遮光剂的晶胞如右图所示,则n=______。
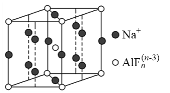
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示
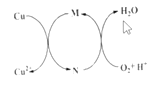
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂,它们的一些性质及制备方法如下所示:
Ⅰ.氯化铁:熔点为306 ℃,沸点为315 ℃,易吸收空气中的水分而潮解。工业上采用向500~600 ℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670 ℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题:
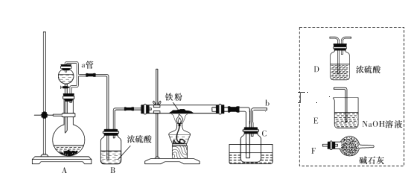
(1)装置A用于KMnO4固体与浓盐酸反应制氯气,a管的作用是______________,反应的离子方程式为__________。
(2)导管b口应与_______________(从虚线框内装置中选择一个装置,用字母代号填空)连接,这样可避免反应系统与环境间的相互影响。
(3)实验完成后,取广口瓶C中收集到的产物进行如下测定
①称取4.2 g样品溶于过量的稀盐酸中;②加入足量H2O2;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40 g。则该样品中铁元素的质量分数为_________。
(4)由以上数据分析和计算得出结论:
①用此装置制得的无水氯化铁含铁量___________ (填“偏高”或“偏低”),显然其中含有较多的___________(填化学式)杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用KIO3溶液氧化酸性溶液中的KI:5I-+ IO3- + 3H2O = 3I2 + 6OH-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2![]()
C.Cu溶于稀HNO3:Cu + 2H+ + NO3- = Cu2+ + NO2↑+ H2O
D.Ca(HCO3)2溶液与足量NaOH溶液反应:2HCO3- + Ca2+ + 2OH-= CaCO3↓ + CO32-+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是
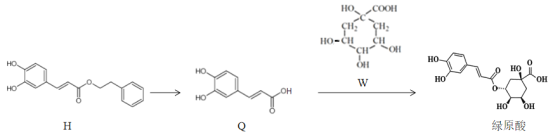
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.1mol绿原酸与足量NaHCO3溶液反应,最多放出1molCO2
D.H、Q、W均能发生氧化反应、取代反应、显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com