
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析不正确的是
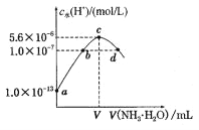
A. 硫酸的浓度为0.05mol/L
B. V=20
C. c点所示的溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d点所示溶液中:c(NH4+)=c(SO42-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是![]()
![]() CuS↓
CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于ΔH的说法正确的是 ( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.ΔH>0时反应放热,ΔH<0时反应吸热
C.ΔH越大,说明反应放出的热量越多
D.一个化学反应中,当反应物能量大于生成物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z是短周期元素,原子序数依次增大。R是自然界中组成物质种类最多的元素,R原子最外层电子数是X原子最外层电子数2倍。Z的最高价氧化物对应的水化物(M)是强电解质,向含Y元素的钠盐溶液中滴加M溶液,产生沉淀的物质的量与M的物质的量关系如图所示。下列推断正确的是
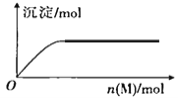
A. R的氢化物可能使溴水或酸性高锰酸钾溶液褪色
B. Y的气态氢化物热稳定性比R的强
C. 常温常压下,Z的单质一定呈黄绿色
D. X和Z组成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述不正确的是
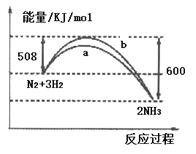
A. 在温度、体积一定的条件下,通入1mol N2和3mol H2 反应后放出的热量为92kJ
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,也不能提高N2的转化率
D. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣92 kJ/mol
2NH3(g) △H=﹣92 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)如图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
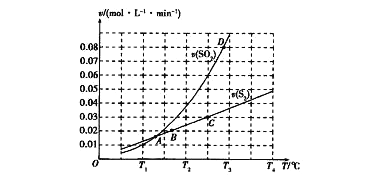
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
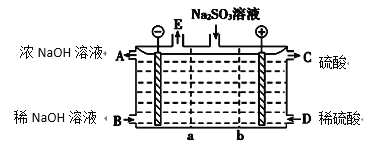
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
①a表示________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中A为浓氢氧化钠溶液,C为硫酸溶液,E表示________(写化学式)。
②电解过程中,阳极的电极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种短周期元素,它们的原子序数依次增大。其中A与C、B与E分别是同主族元素。已知B、E两元素间可形成EB2和EB3两种化合物,两者相对分子质量相差16。又知A、C两元素原子序数之和是B、E两元素原子序数之和的![]() , D的单质是一种常见的半导体材料。请回答下列问题:
, D的单质是一种常见的半导体材料。请回答下列问题:
(1)D位于元素周期表的位置是___________________。
(2)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:________,该化合物中所含化学键的类型有_________________。
(3)A2B与A2E的沸点:A2B______A2E(填“高于”或“低于”),其原因是:___________________________。
(4)由A、B、C、E四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体。写出X与盐酸反应的离子方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com